现在的位置:主页 > 期刊导读 >
山茱萸bHLH2基因的克隆与分析
【作者】网站采编【关键词】【摘要】山茱萸( Cornus officinalis )为山茱萸科多年生的木本植物,《中华人民共和国药典》规定山茱萸以干燥的成熟果肉入药,具有补益肝肾的功效 [1] 。山茱萸广泛分布在中国的秦岭、伏牛山等
山茱萸(Cornus officinalis)为山茱萸科多年生的木本植物,《中华人民共和国药典》规定山茱萸以干燥的成熟果肉入药,具有补益肝肾的功效[1]。山茱萸广泛分布在中国的秦岭、伏牛山等地[2]。山茱萸的果实中含有多种活性物质,如多糖、环烯醚萜苷类、黄酮类和鞣质等[3]。研究表明,山茱萸具有广泛的药理活性,如保护肝肾、抗糖尿病、抗氧化、抗肿瘤、抗炎、抗衰老等[4-7]。现今山茱萸在临床上的应用已十分广泛。
1.1.2 囊袋感染 囊袋感染为起搏器术后感染最常见的并发症,其感染率为 0.13% ~ 19.9%[3,5]。囊袋感染者起搏电极血管内部位79.3%细菌培养阳性,电极外露部位91.6%细菌培养阳性[6-7]。病原菌多系葡萄球菌,尤其常见金黄色葡萄球菌。囊袋感染一般发生在术后2~4 d。
bHLH(basic Helix-loop-helix)类转录因子的C端含有α-螺旋-环-α-螺旋结构,N端则由碱性氨基酸组成,因此得名[8]。HLH区结构富含疏水性氨基酸,主要是与DNA结合从而发挥功能[9]。bHLH类转录因子广泛存在于真核生物,是植物中最大的转录因子家族之一。bHLH转录因子家族成员对植物生长过程中起着重要的调控作用[10],如调节花青素的物质合成[11]、植物抗逆性[12]、腺毛或根毛的形成以及表皮细胞建成[13-14]等生理作用。MYC蛋白的主要是由2个bHLH蛋白聚合形成的[15-16],2个结构域共同参与了活性DNA结合复合物的形成[17]。有研究表明,bHLH转录因子在植物体内还可与MYB转录因子协同发挥作用,可调控黄酮类物质的合成[18]。完整的bHLH蛋白还可与缺少碱性区域的bHLH蛋白结合形成二聚体,从而抑制目的基因的表达[19]。
众多研究发现bHLH类转录因子对黄酮类、生物碱类、萜类等物质的合成有重要的调控作用。CsbHLHs和CsMYBs转录因子在山茶生长过程中有特定的表达模式用以调节重要的类黄酮物质的合成,有助于山茶形成独特的风味[20]。丹参SmbHLH3的过表达植株使得丹参酮等活性物质含量减少,功能鉴定结果表明SmbHLH3可通过抑制丹参酮合成关键酶的转录而下调其在植物体内的积累[21]。PbbHLH4过表达可显著增加蝴蝶兰中挥发性单萜物质的合成和积累,显著增加了该兰花的香气[22]。
从各种物性指标来看硬度值越低,嫩度越高[14]。说明犊牛肉的硬度比成年牛肉低,嫩度比成年牛肉高。其中里脊的嫩度最好。这与上面剪切力值的结果是一致的。
2.3 CobHLH2编码蛋白的特征分析 利用NCBI提供的ORFfinder工具预测,CobHLH2序列含有一个完整的ORF,长795 bp,共编码264个氨基酸。ProtParam分析表明,CobHLH2蛋白分子式为C1268H2030N370O411S8,相对分子质量为29.29 kDa,其理论pI值8.77。利用ProtScale工具分析CobHLH2蛋白的亲/疏水性,结果见图3,总体来看,该蛋白整体的亲水性氨基酸数量要多于疏水性氨基酸,因此初步推定此蛋白为亲水性蛋白。
2.2 CobHLH2克隆与测序 利用Primer Premier 5.0软件,在转录本c101916_g1序列的ORF两端设计特异性引物(CobHLH2-F和CobHLH2-R)。以山茱萸的第一链cDNA为模板,RT-PCR扩增后经1.0%的凝胶电泳检测,结果见图2所示。回收纯化该亮带,与载体pTOPO-T连接,转化感受态DH5α,经菌液PCR鉴定,挑选阳性菌液测序。测序结果去除污染载体序列,获得长度为1 047 bp的CobHLH2目的片段。
1 材料与方法
1.1 材料 试验材料选自河南省洛阳市隋唐城遗址植物园,用蒸馏水清洗果实,快速分离果肉置于离心管中,液氮速冻后储存在-70 ℃超低温冰箱内。
1.重点发展少数民族文化特色酒店。一是酒店建筑设计融入少数民族文化元素。挖掘广西壮族、瑶族、苗族、侗族、京族等少数民族建筑文化,将壮族干栏式民居、铜鼓、壮锦、花山岩画、侗族鼓楼等文化元素进行升华优化,运用于酒店设计中,使酒店展现出浓浓的民族风情。二是策划有民族特色的娱乐活动。将少数民族歌舞、戏剧融入度假酒店的休闲娱乐项目,营造浓郁的民族文化氛围。三是打造有民族特色的酒店餐饮。有广西特色的美食融入到酒店的餐饮中,成为吸引顾客的途径。四是酒店服务人员身穿少数民族服饰,以营造浓郁的民族文化氛围。
1.5 CobHLH2基因克隆与测序 CobHLH2基因的PCR体系是25 μL,2×long Taq Master Mix 12.5 μL,上下游引物终浓度为0.1 μM,cDNA模板为1.5 μL,ddH2O补足体积。设定的程序为94 ℃预变性5 min,设置32个循环,95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,循环结束后,72 ℃延伸5 min。待PCR结束后电泳检测,回收纯化目的条带,与T载体连接后转化E.coli DH5α感受态细胞,在含有氨苄青霉素(Amp)抗性的LB固体平板上过夜培养,经菌液PCR检测后送至上海美吉生物公司测序。
1.4 总RNA提取与cDNA合成 将试验材料放置于液氮中并充分研磨,根据RN35-EASYspinPlus多糖多酚植物总RNA快速提取试剂盒的说明提取山茱萸的总RNA。取适量总RNA,用1%的琼脂糖凝胶检测其完整性,并利用MultiskanGO酶标仪检测其纯度和浓度。按照TRUEscript 1st Strand cDNA Synthesis Kit的说明书将总RNA逆转录成cDNA,-20 ℃保存备用。
1.3 引物设计 以山茱萸转录组数据筛选得到的Unigene c101916_g1序列为参考,利用Primer Premier 5.0软件设计特异引物,引物序列为CobHLH2F:5′-TCGGTGCTTATTTCGGTTGG-3′ 和CobHLH2R:5′-CTCCCTACTACTTCCCCACT-3′,引物送华大基因有限公司合成。
2.5 CobHLH2的同源性分析 利用NCBI数据库的BLASTp工具搜索CobHLH2蛋白的相似性较高的序列,序列下载后用DANMAN 8.0软件进行多序列比对,结果如图7所示,CobHLH2与蓝果树(Nyssa sinensis,KAA8517024)、葡萄(Vitis vinifera,XP_002282897)、菜豆(Phaseolus vulgaris,XP_007162273)、胡桃(Juglans regia,XP_018858223)、猕猴桃(Actinidia chinensis,PSS36323)、番木瓜(Carica papaya,XP_021894046)、豇豆(Vigna unguiculata,QCD97477)、茶树(Camellia sinensis,XP_028114859)等序列相似性较高,表明植物bHLH类转录因子在进化过程中相对保守。
2 结果与分析
2.1 山茱萸果实总RNA提取 取若干无酶的装有3个小钢珠的1.5 mL离心管,向其中加入约100 mg的山茱萸果肉,利用球磨仪将其研磨成粉状,按照植物总RNA提取试剂盒提取其总RNA。1.2%琼脂糖凝胶电泳检测结果见图1,RNA的条带清晰,可进行cDNA第一链的合成。
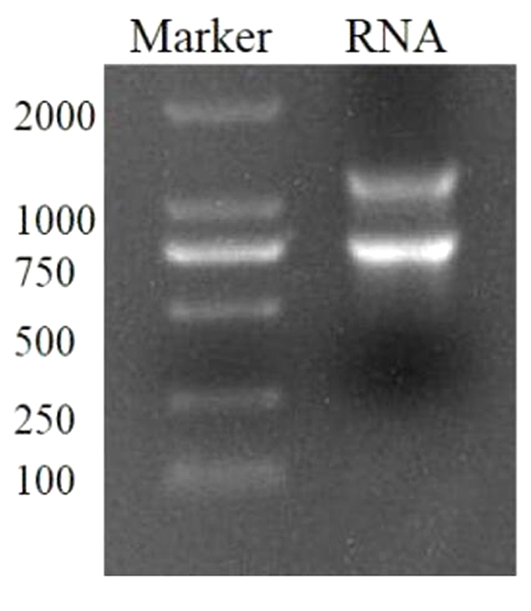
图1 山茱萸果实总RNA提取
底座通过行星齿轮机构来实现折臂式铁钻工的回转,行星齿轮由主动齿轮1、从动齿轮2、回转大齿轮3、行星架H(底座上盖)等组成,行星机构如图7所示[7]。

图2 CobHLH2目的片段扩增
本研究根据山茱萸转录组测序结果[23],成功克隆了山茱萸CobHLH2基因,并利用生物信息学分析该基因序列及其编码蛋白,为研究转录因子bHLH转录因子在山茱萸生长代谢过程中的功能奠定了基础。
利用Conserved Domain-search工具分析CobHLH2蛋白的保守结构域,结果见图4,CobHLH2蛋白具有HLH结构域和特定的DNA结合位点,表明该编码蛋白属于bHLH转录因子超家族。
1.2 试剂与仪器 EASYspinPlus多糖多酚植物总RNA快速提取试剂盒(RN37)、TRUEscript 1st Strand cDNA Synthesis Kit(PC1802)、2×long Taq PCR Master Mix(PC1501)、琼脂糖凝胶纯化回收试剂盒(DR01)与Zero Background pTOPO-TA Cloning Kit(CV2101)均购买自艾德莱生物科技;DH5α感受态细胞(上海昂羽生物公司,型号:AYBIO-G6016);氨苄青霉素(北京索莱宝科技有限公司,型号:A7490)。Thermo MultiskanGO酶标仪(Thermo公司,美国,型号:MultiskanGO)、PCR仪(Biometra公司,德国,型号:Tpersonal)、台式高速冷冻离心机(Sigma公司,德国,型号:3K15)、电泳仪(BIO-RAD公司,美国,型号:PowerPac Basic)。
2.4 CobHLH2二级、三级结构预测 利用SOPMA工具在线预测CobHLH2蛋白的二级结构,结果见图5。CobHLH2蛋白的二级结构共有4种,无规卷曲(紫色)、α-螺旋(蓝色)、延伸链(红色)与β-转角(绿色)所占比例分别为48.48%、33.33%、12.12%、6.06%。
利用SWISS-MODEL工具在线预测构建CobHLH2蛋白的三维结构见图6。其三维结构主要是α-螺旋与无规卷曲,这与预测的CobHLH2蛋白的二级结构一致。
1.6 CobHLH2的生物信息学分析 利用美国生物技术信息中心数据库(NCBI)提供的ORFfinfer和Conserved Domains-search在线分析其开放读码框(ORF)及保守结构域;使用ProtParam tool和ProtScale在线分析CobHLH2编码蛋白的理化性质与亲/疏水性;利用SOPMA网站在线分析CobHLH2的二级结构,并利用SWISS-MODEL工具构建其三维模型;利用BLAST搜索与CobHLH2相似性较高的氨基酸序列,并利用DANMAN 8.0进行多序列比对,基于多序列比对结果使用MEGA 7.0构建NJ树分析其同源性。
基于CobHLH2的多序列比对结果,利用MEGA 7.0软件构建CobHLH2的NJ树,并通过1 000次Bootstrap重复检验系统树各分支的可信度。结果见图8,山茱萸CobHLH2序列与猕猴桃(Actinidia chinensis,PSS36323)和茶树(Camellia sinensis,XP_028114859)的亲缘关系较近,而与几个豆科植物的亲缘关系较远。
通过表4分析可以发现,椒江流域剧烈土壤侵蚀主要发生在其他(居民地)、裸地和旱地.对比其占各自土地利用类型所发生土壤侵蚀的比例,尤以未保护的裸地为甚,剧烈侵蚀占裸地在1995年、2000年、2005年、2010年及2015年各类侵蚀等级的比例分别为15.86%、31.47%、31.51%、30.61%及24.27%.轻度土壤侵蚀主要发生在林地,其他(居民地)和旱地次之.中度土壤侵蚀主要发生在林地,旱地及其他(居民地)次之.极强烈土壤侵蚀主要发生在旱地,裸地及其他(居民地)次之.综合分析可以发现,其他(居民地)、裸地及旱地应该是土壤侵蚀防治的重点区域.
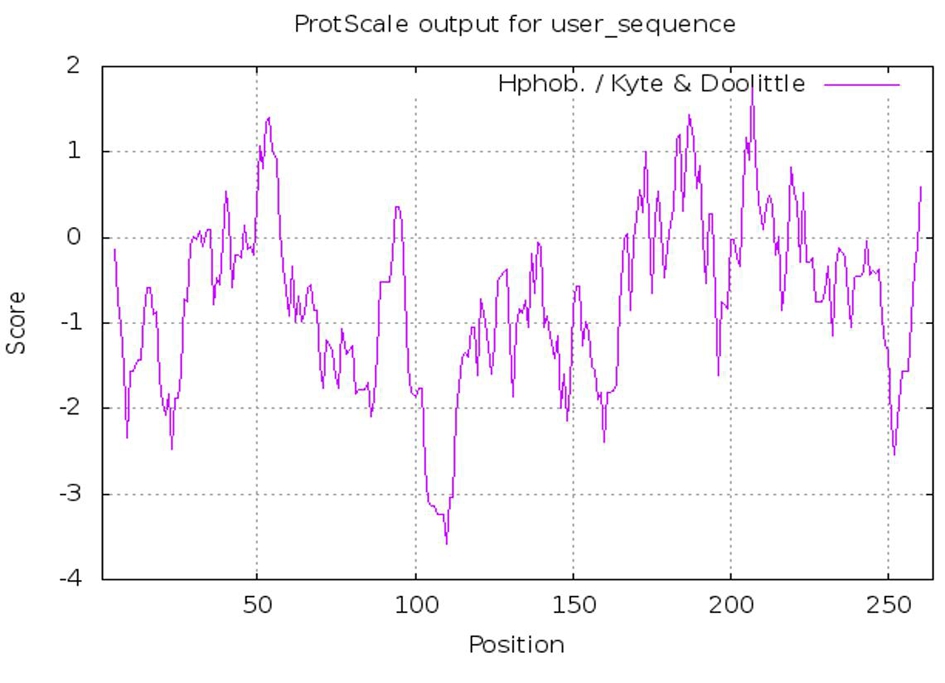
图3 CobHLH2蛋白亲/疏水性分析

图4 CobHLH2蛋白的保守结构域预测
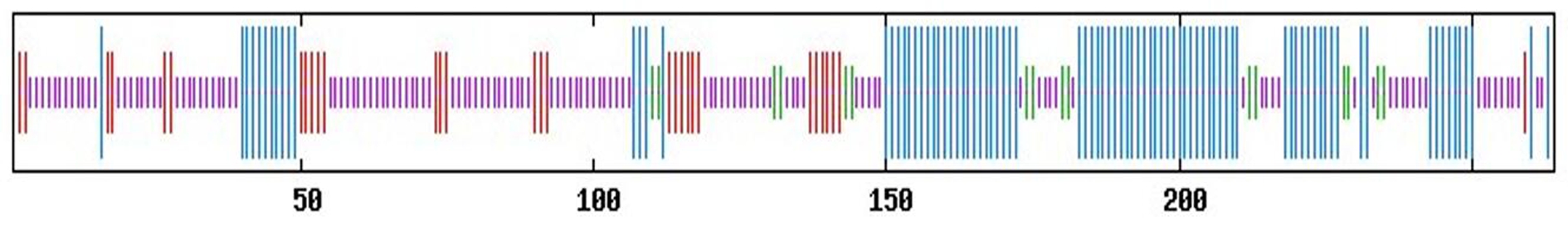
图5 CobHLH2二级结构分析
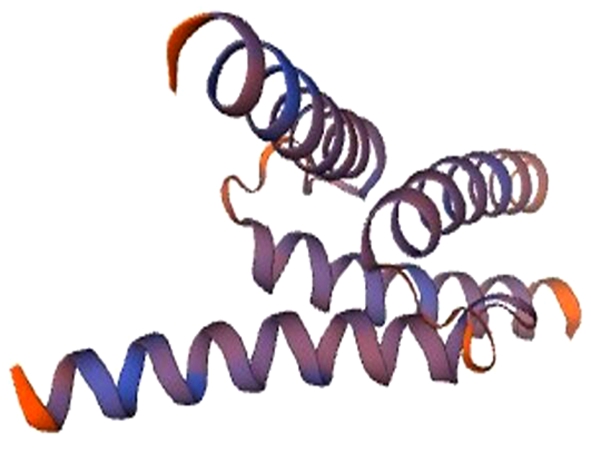
图6 CobHLH2蛋白的三维结构
3 讨论
药用植物的提取物或其衍生物是许多化学药物的重要原料,其中多数已是临床用药[24],但关于药用植物活性物质的生物合成途径及其调控机制的研究较为缓慢。随着本草基因组学的提出和快速发展[25],利用全基因组学和转录组学测序技术获得大量的基因组数据,是研究药用植物功能基因组学的重要基础[26]。铁皮石斛[27]、人参[28]等药用植物活性物质合成的基因组研究已取得了较大的进展。
本研究基于对山茱萸转录组测序数据分析的基础上[23],通过基因克隆,获得了CobHLH2序列,并进行相关分析。结果表明,CobHLH2序列含有HLH保守结构域和相应的保守序列,与已报道文献一致[29],属于bHLH转录因子家族。bHLH转录因子对药用植物的有效成分含量具有重要的调节作用,有研究表明MYC2过表达可产生较多的花青素,且转基因拟南芥植株对茉莉酸甲酯的敏感性高于野生型[30]。白桦BpbHLH4[31]和乌拉尔甘草GubHLH3[32]的表达可影响三萜类及其皂苷等物质的生物合成。长春花CrBIS1亦是bHLH转录因子家族中的成员,与单萜类物质吲哚生物碱的生物合成途径有关[33]。当前,利用高通量转录组测序[34]和基因工程等技术,改进药用植物有效成分合成过程中的调控元件,可极大地提高活性物质的含量,有助于提高药用植物的经济价值。
2007年开始在本区大面积推广应用频振式杀虫灯,截至2013年本区共在33个作物基地安装频振式杀虫灯540盏,灯控面积36 090亩,涉及水稻、蔬菜、果树、中药材等,通过物理灭虫的方式达到绿色控害效果,但相较本区10多万亩的耕地面积,控害面积还远远不够,无法满足本区发展无公害农业的要求。下一步,本区要在各种特色作物上安装频振式太阳能杀虫灯,大力加强对病虫害的物理控制,大量减少农药施用,保障农产品品质安全,使本区农业走上生态、高效、可持续发展的健康大道。
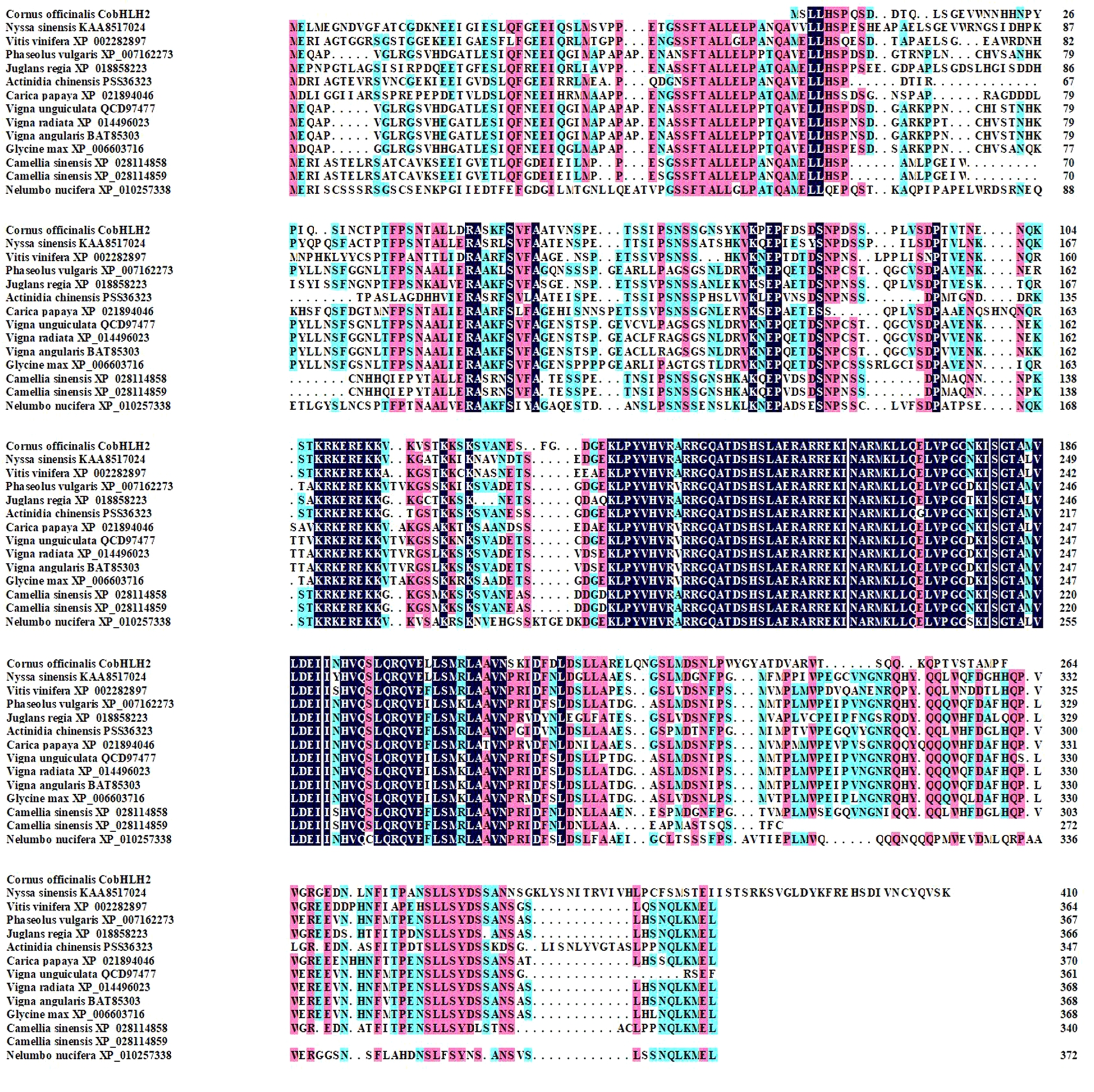
图7 CobHLH2多序列比对
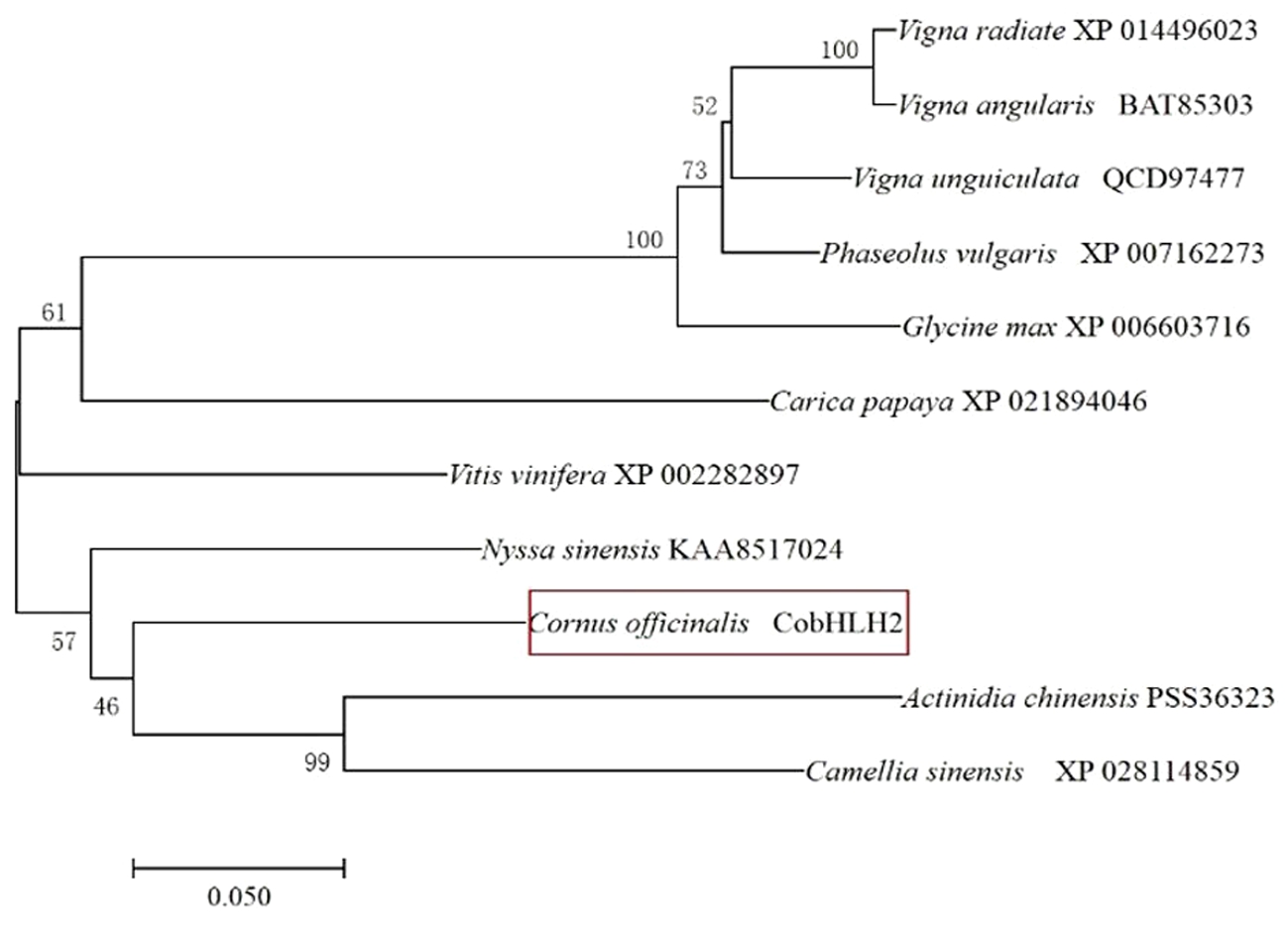
图8 CobHLH2系统发生树
现今,山茱萸的基因组数据较为匮乏,其次生代谢物的生物合成的分子机制与转录调控机理的研究也较少。本研究已获得了山茱萸的CobHLH2序列,并进行了结构特征和同源性分析,对于其功能分析还需深入研究,进一步丰富山茱萸基因组学数据,从而发现山茱萸生长发育过程与次生代谢产物积累的之间的分子机理,为山茱萸活性物质的大量合成积累奠定基础。
[1]中华人民共和国药典[S].北京:中国医药出版社,2015:27-28.
[2]Bai CK,Cao B,Li GH,et al.Ecological effects on phenotypic,cytological and biochemical diversity of Cornus officinalis germplasm resources in China and USA[J].Biochem Syst Ecol,2014,55:241-248.
[3]Ma W,Wang KJ,Cheng CS,et al.Bioactive compounds from Cornus officinalis fruits and their effects on diabetic nephropathy[J].J Ethnopharmacol,2014,153(3):840-845.
[4]丁霞,王明艳,余宗亮,等.山茱萸中5-羟甲基糠醛的分离鉴定及生物活性研究[J].2008,33(4),392-396,484.
[5]Lee KY,Sung SH,Kim SH,et al.Cognitive-enhancing activity of loganin isolated from C.of cinalis in scopolamine-induced amnesic mice[J].Arch Pharm Res,2009,32(5):677-683.
cinalis in scopolamine-induced amnesic mice[J].Arch Pharm Res,2009,32(5):677-683.
[6]周瑞,唐志书,武婧,等.基于抗类风湿关节炎作用评价膜分离技术富集山茱萸抗炎组分的适用性[J].中草药,2019,50(5):1182-1188.
[7]Huang J,Zhang Y,Dong L,et al.Ethnopharmacology,phytochemistry,and pharmacology of Cornus officinalis Sieb.et Zucc[J].J Ethnopharmacol,2018,213:280-301.
[8]Atchley WR,Fitch WM.A natural classification of the basic helix-loop-helix class of transcription factors[J].Proc Natl Acad Sci U S A,1997,94(10):5172-5176.
[9]Pires N,Dolan L.Origin and diversification of basic-helix-loop-helix proteins in plants[J].Mol Biol Evol,2010,27(4):862-874.
[10]Sonnenfeld MJ,Delvecchio C,Sun X.Analysis of the transcriptional activation domain of the Drosophila tango bHLH-PAS transcription factor[J].Dev Genes Evol,2005,215(5):221-229.
[11]Feng S,Wang Y,Yang S,et al.Anthocyanin biosynthesis in pears is regulated by a R2R3-MYB transcription factor PyMYB10[J].Planta,2010,232(1):245-255.
[12]Anjum SA,Wang L,Farooq M,et al.Methyl jasmonate-induced alteration in lipid peroxidation,antioxidative defence system and yield in soybean under drought[J].J Agron Crop Sci,2011,197(4):296-301.
[13]Fan M,Bai MY,Kim JG,et al.The bHLH transcription factor HBI1 mediates the trade-off between growth and pathogen-associated molecular pattern-triggered immunity in Arabidopsis[J].Plant Cell,2014,26(2):828-841.
[14]Hichri I,Barrieu F,Bogs J,et al.Recent advances in the transcriptional regulation of the flavonoid biosynthetic pathway[J].J Exp Bot,2011,62(8):2465-2483.
[15]Ferré-D′amaré AR,Prendergast GC,Ziff EB,et al.Recognition by Max of its cognate DNA through a dimeric b/HLH/Z domain[J].Nature,1993,363(6424):38-45.
[16]Ferré-D′amaré AR,Pognonec P,Roeder RG,et al.Structure and function of the b/HLH/Z domain of USF[J].EMBO J,1994,13(1):180-189.
[17]Chang WH,LAI AG.Genome-wide analyses of the bHLH superfamily in crustaceans:reappraisal of higher-order groupings and evidence for lineage-specific duplications[J].R Soc Open Sci,2018,5(3):172433.
[18]Nakatsuka T,Haruta KS,Pitaksutheepong C,et al.Identification and Characterization of R2R3-MYB and bHLH Transcription Factors Regulating Anthocyanin Biosynthesis in Gentiana Flowers[J].Plant Cell Physiol,2008,49(12):1818-1829.
[19]Sun H,Fan HJ,Ling HQ.Genome-wide identification and characterization of the bHLH gene family in tomato[J].BMC Genomics,2015,16(1):9.
[20]Zhu J,Xu Q,Zhao S,et al.Comprehensive co-expression analysis provides novel insights into temporal variation of flavonoids in fresh leaves of the tea plant(Camellia sinensis)[J].Plant Sci,2020,290:110306.
[21]Zhang C,Xing B,Yang D,et al.SmbHLH3 acts as a transcription repressor for both phenolic acids and tanshinone biosynthesis in Salvia miltiorrhiza hairy roots[J].Phytochemistry,2020,169:112183.
[22]Chuang YC,Hung YC,Tsai WC,et al.PbbHLH4 regulates floral monoterpene biosynthesis in Phalaenopsis orchids[J].J Exp Bot,2018,69(18):4363-4377.
[23]Hou DY,Shi LC,Yang MM,et al.De novo transcriptomic analysis of leaf and fruit tissue of Cornus officinalis using Illumina platform[J].PloS One,2018,13(2):e0192610.
[24]陈士林,孙永珍,徐江,等.本草基因组计划研究策略[J].药学学报,2010,45(7):807-812.
[25]宋经元,徐志超,陈士林.本草基因组学专辑简介[J].中国科学:生命科学,2018,48(4):349-351.
[26]宋经元,罗红梅,李春芳,等.丹参药用模式植物研究探讨[J].药学学报,2013,48(7):1099-1106.
[27]Yan L,Wang X,Liu H,et al.The genome of Dendrobium officinale illuminates the biology of the important traditional Chinese orchid herb[J].Mol Plant,2015,8(6):922-934.
[28]Xu J,Chu Y,Liao B,et al.Panax ginseng genome examination for ginsenoside biosynthesis[J].Gigascience,2017,6(11):1-15.
[29]Zhang X,Luo H,Xu Z,et al.Genome-wide characterisation and analysis of bHLH transcription factors related to tanshinone biosynthesis in Salvia miltiorrhiza[J].Sci Rep,2015,5:11244.
[30]An JP,Li HH,Song LQ,et al.The molecular cloning and functional characterization of MdMYC2,a bHLH transcription factor in apple[J].Plant Physiol Biochem,2016,108:24-31.
[31]Yin J,Li X,Zhan Y,et al.Cloning and expression of BpMYC4 and BpbHLH9 genes and the role of BpbHLH9 in triterpenoid synthesis in birch[J].BMC Plant Biol,2017,17(1):214.
[32]Tamura K,Yoshida K,Hiraoka Y,et al.The basic helix-loop-helix transcription factor GubHLH3 positively regulates soyasaponin biosynthetic genes in Glycyrrhiza uralensis[J].Plant Cell Physiol,2018,59(4):778-791.
[33]Van Moerkercke A,Steensma P,Schweizer F,et al.The bHLH transcription factor BIS1 controls the iridoid branch of the monoterpenoid indole alkaloid pathway in Catharanthus roseus[J].Proc Natl Acad Sci U S A,2015,112(26):8130-8135.
[34]陈延清,胡志刚,刘大会,等.药用植物冬凌草高通量转录组测序与分析[J].中国现代中药,2018,20(12):1476-1482.
Cloning and Analysis of Transcription CobHLH2 Genes in Cornus officinalis
文章来源:《世界睡眠医学杂志》 网址: http://www.sjsmyxzz.cn/qikandaodu/2020/0522/345.html
上一篇:百会及印堂穴对七氟醚麻醉后大鼠认知功能的影
下一篇:麻荆颗粒质量标准研究

