现在的位置:主页 > 期刊导读 >
基于18SrRNA序列的云南大叶千斤拔与细叶千斤拔根
【作者】网站采编【关键词】【摘要】千斤拔属( Flemingia )植物多为灌木或亚灌木,全球有40余种,主要分布于亚洲、非洲、大洋洲的热带地区,我国有16种及1变种 [1] 。2015版《中华人民共和国药典》收载千斤拔药材来源为豆
千斤拔属(Flemingia)植物多为灌木或亚灌木,全球有40余种,主要分布于亚洲、非洲、大洋洲的热带地区,我国有16种及1变种[1]。2015版《中华人民共和国药典》收载千斤拔药材来源为豆科植物蔓性千斤拔Flemingia pholippinensis、大叶千斤拔Flemingia macrophylla和绣毛千斤拔Flemingia ferruginea的干燥根。此外,《中国植物志》《现代中药学大辞典》和《药用植物词典》中指出大部分千斤拔属植物均可供药用。千斤拔及相关中成药产品主要用于妇科疾病、风湿痹痛、体虚贫血、坐骨神经痛、咽喉肿痛、跌打损伤等方面的治疗[2-3]。分离自千斤拔属植物的化合物主要包括黄酮类、酚类、甾体类、蒽醌类、挥发油类等[4],其中异戊烯基取代黄酮类成分是千斤拔属植物的主要成分和特征成分[5]。相关药理研究表明黄酮类化合物具有显著的抗氧化、抗肿瘤、保护肝脏及心血管系统的活性[6-7];萜类与甾类等化合物具有抗菌驱虫、抗氧化等作用[8]。随着千斤拔相关产品的开发,市场需求量日益增大,千斤拔属植物的人工繁殖势在必行,我国已相继开展了种子繁殖、离体繁殖、扦插繁殖等千斤拔人工栽培技术研究。有研究表明,千斤拔属植物有效成分的积累与种质资源和环境条件都息息相关[9-10]。丛枝菌根真菌作为与植物关系最为密切的土壤微生物,可与绝大多数植物形成共生体,从而影响植株的生长微环境[11]。
大众审美是整容审美的一个风向标,也是一个显示器。当大众审美倾向于成熟性感时,女人会选择隆胸、垫欧式鼻梁、开欧式平行双眼皮,当时的整容模板是范冰冰。而当大众审美偏向于清新自然时,内扇型的双眼皮、韩式小翘鼻是首选。
丛枝菌根真菌作为“生物肥料”已广泛应用于农作物生产[12],其不仅改善植物营养状况、促进植物对养分元素的吸收和代谢、同时提高植物对不良环境和病虫害的抵抗能力。因此,丛枝菌根真菌在药用植物栽培,尤其是根、茎为主要药用部位的药用植物人工繁殖方面的应用研究也逐渐受到关注。相关研究表明,接种丛枝菌根真菌之后,可提高半夏块茎中鸟苷、生物碱等化学成分含量[13];可以显著提高川黄柏幼苗的小檗碱含量[14];可增加北柴胡皂苷A和地上部分黄酮含量[15]。明确原生地药用植物根内丛枝菌根真菌群落组成,将有助于了解该植物与土壤微生物处于最佳关系时的微生物群落结构,为优化人工栽培环境提供有力地理论依据。
或许全新路虎发现上市至今的销量证明其设计并不被多数中国人认可,但这并不影响全新路虎发现成为新英国车设计的杰出代表。相比以往的霸气外露、直抒胸臆来说,如今的路虎发现更讲究类似中国文化里的深藏不露与内力十足。
得益于分子生物学技术日益成熟,对不可纯培养的丛枝菌根真菌群落结构的鉴定方法也不仅限于对根外孢子的传统形态学显微观察法,根内丛枝菌根真菌群落组成亦成为关注焦点[16]。前者可获得优质的丛枝菌根真菌种质资源便于开展应用研究,后者可直接获得根内丛枝菌根真菌的群落结构信息,真实反应与植物直接发生作用的丛枝菌根真菌种类[17]。本文分别以2015版《中华人民共和国药典》收载物种大叶千斤拔和非药典收载的药用物种细叶千斤拔为研究对象,通过根内丛枝菌根真菌18s rRNA克隆文库构建及RFLP分析,考察二者根系中丛枝菌根真菌群落结构及其种属间的差异,旨在为解决千斤拔栽培中的相关问题提供理论依据。
1 材料与方法
1.2.3 孢子密度的测定 称取10 g风干土样,湿筛倾析-蔗糖离心法分离丛枝菌根真菌孢子,在体视显微镜下计数[20]。
表1 试验样品信息表
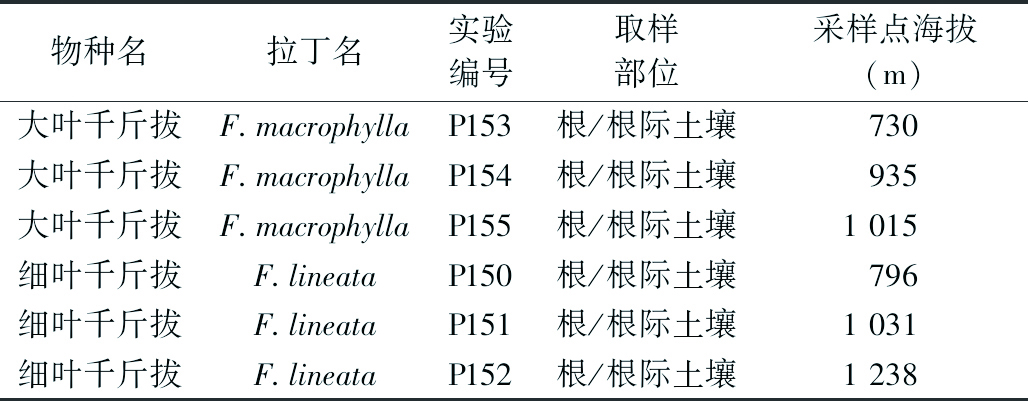
物种名拉丁名实验编号取样部位采样点海拔(m)大叶千斤拔F.macrophyllaP153根/根际土壤730大叶千斤拔F.macrophyllaP154根/根际土壤935大叶千斤拔F.macrophyllaP155根/根际土壤1015细叶千斤拔F.lineataP150根/根际土壤796细叶千斤拔F.lineataP151根/根际土壤1031细叶千斤拔F.lineataP152根/根际土壤1238
2.2 根内丛枝菌根真菌克隆文库的构建及其群落多样性分析 全部大叶千斤拔与细叶千斤拔根系样品均成功扩增出根内丛枝菌根真菌18S rRNA序列。采样点分别建立克隆文库。见表4。每个物种有3个采样点样本,每个样本选出94个阳性克隆,2个物种3个采样点样本的总克隆数均为282个,测序后舍去非丛枝菌根真菌序列。大叶千斤拔样品克隆文库获得276个克隆,细叶千斤拔样品获得282个克隆。克隆文库的覆盖度均在97%以上,可以较好地代表各样本中丛枝菌根真菌的多样性。
1.2.1 侵染强度的测定 每份根系样品选取30个1 cm左右的幼嫩根系,经0.05%曲利苯蓝染色后,在显微镜下测定侵染率。根据菌根侵染分级标准和丛枝泡囊丰度分级标准对根段进行侵染率级别判断,使用“MYCOCALC”软件,计算侵染强度(M%),该指标是真菌侵入植物根系的频度与强度的综合反应[19]。
1.2.2 菌丝密度的测定 称取5 g过1 mm筛的土壤样品,采用双层筛过滤法提取根外菌丝至微孔滤膜上,0.05%曲利苯蓝染色后观察菌丝[20]。每张微孔滤膜上选取均匀分布的25个样点进行观察、统计[19]。
1.1 样品采集及处理 大叶千斤拔和细叶千斤拔样品均于2012年1月采自景洪至勐海县的G214国道沿途。见表1。采样地位于云南省西双版纳傣族自治州,地处北回归线以南的热带北部边缘,全年干湿季分明,降雨主要集中在5月下旬至10月下旬,全年平均降雨量为1 557 mm,全年平均气温为21.5 ℃,属热带季风气候[18]。随机选取植株生长的3个地点,在根围选择5个采样点,每个采样点采集一份根系样本,将5个采样点的根系样品混合后作为该生长地点的一份根系样品。在距植株30~50 cm处采集20~30 cm深处的土样和细根样,编号、装入自封袋后置入冰盒带回。将根系样品清洗干净后于-80 ℃冰箱中保存备用。土样风干保存。
双酚A(BPA),是一种重要的化工有机原料,苯酚和丙酮的衍生物,用于合成环氧树脂、聚砜树脂、聚碳酸酯等高分子材料,也用于增塑剂、抗氧化剂、热稳定剂等化工产品。然而最受关注的是双酚A对于人类的影响[1-2],它可通过各类食品包装材料、奶瓶、水杯、餐具,甚至是最常见的水渗入人体,作为一种环境内分泌干扰物造成人中枢、生殖、心血管系统的癌变[3-4]。为了保证食品及水样的安全,对其中BPA残留检测方法的研究具有重大意义。
1.3 根内丛枝菌根真菌分子多样性
1.3.1 根系样品DNA的提取 取约200 mg根系样品,经表面消毒后(75%乙醇30 s、1%次氯酸钠3 min、无菌水冲洗3次),用CTAB法提取植物基因组试剂盒(北京艾德莱生物科技有限公司,中国,批号:181953)并按照操作手册进行根系样品DNA提取,于-20 ℃保存备用。
2.1 根际丛枝菌根真菌概况 大叶千斤拔与细叶千斤拔根际丛枝菌根真菌的侵染强度、孢子密度和菌丝密度等数据见表3。大叶千斤拔除了菌丝密度与细叶千斤拔比较差异无统计学意义,侵染强度和孢子密度均显著低于细叶千斤拔。
1.3.4 序列分析与系统发育树构建 使用BLAST软件与GenBank数据库进行在线比对,去除非丛枝菌根真菌序列。利用DUTOR软件按序列相似水平进行序列类群划分,相似性大于97%的序列划分为同一相似水平的OTUs。按所划分的可操作分类单元对Shannon多样性指数(H′)、相对多度(Relative Abundance)、重要值(Important Values)进行统计[20]。采用ClusterX软件对代表序列与参考序列处理后,用Mega7.0软件进行Neighbor-Joining系统发育分析。随后,将本研究所获得的代表序列与MaarjAM数据库[25](http://maarjam.botany.ut.ee)进行比对,序列相似度大于97%鉴定为一个分子虚拟分类种(Molecular Virtual Taxon)。
表2 Nested-PCR引物列表
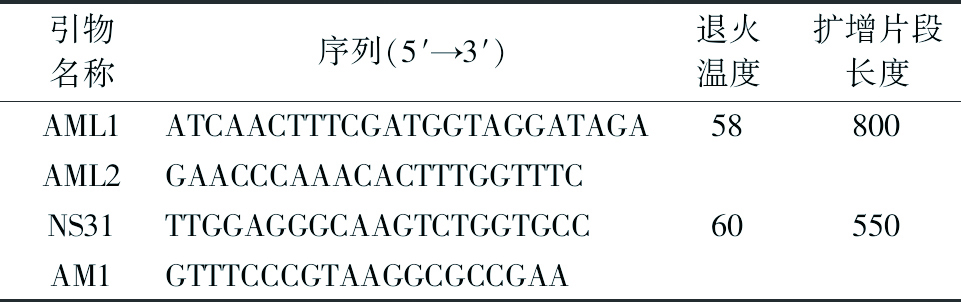
引物名称序列(5′→3′)退火温度扩增片段长度AML1ATCAACTTTCGATGGTAGGATAGA58800AML2GAACCCAAACACTTTGGTTTCNS31TTGGAGGGCAAGTCTGGTGCC60550AM1GTTTCCCGTAAGGCGCCGAA
1.3.3 RFLP分析与克隆文库构建 合并每份样品的3个技术重复的PCR产物,并使用胶回收试剂盒进行纯化(北京艾德莱生物科技有限公司,中国),纯化产物用于构建丛枝菌根真菌18S rRNA克隆文库(共6个文库)。经蓝白斑筛选,将阳性转化子进行扩增后,用HinfI(Fermentas,立陶宛)进行RFLP分析。使用2%琼脂糖凝胶电泳对酶切产物进行检测并划分RFLP谱型,RFLP谱型仅在同一克隆文库内比较,不合并不同克隆文库间的RFLP谱型。每一RFLP谱型随机挑取一个克隆子进行DNA序列测定(苏州金唯智生物科技有限公司,中国),若测序结果不好或不能测出的克隆,则选取相同RFLP类型的另一克隆子进行测序。
1.3.2 巢式PCR扩增 为更全面地获得根内丛枝菌根真菌群落组成,第1次PCR所用引物为丛枝菌根真菌特异引物AML1/AML2[22]表2、扩增模版为根系样品总DNA,第2次PCR所用引物为丛枝菌根真菌特异引物NS31/AM1[23-24]、扩增模版为稀释1 000倍后的第1次PCR产物。按照EasyTaq KIT说明书(北京全式金生物技术有限公司,中国,批号:G21017)依次进行PCR反应。2次PCR产物均用1%琼脂糖凝胶电泳进行检测。每份DNA样品进行3次技术重复。
本文将对氧化石墨烯复合材料的研究进行综述,着重对其制备类型、在有机污染物处理中的应用等方面进行介绍,并根据现状分析目前研究中尚存在的问题,及对今后的研究工作提出一些建议。
2 结果与分析
目前,劳力士3131、3135、3555、3186机心采用的是KIF防震器,3255、3132、3136、3156、3187、9001等新机心则采用Paraflex防震器。
表3 大叶千斤拔与细叶千斤拔丛枝菌根真菌侵染强度、孢子密度和菌丝密度

样品侵染强度(%)孢子密度(个/g)菌丝密度(m/g)大叶千斤拔28.483.171.59细叶千斤拔38.85?5.62?1.14
注:*P<0.05为差异有统计学意义
1.2 丛枝菌根侵染相关指标测定
通过RFLP条带类型,进一步划分克隆子类型;大叶千斤拔样本有48个RFLP条带类型,细叶千斤拔样本有35个,共获得83条测序结果。按97%相似度划分可操作分类单元(OTU),共划分23个OTUs,每个OTU中随机选取一条序列为代表序列(GenBank号:MN904800-MN904822);大叶千斤拔根系样本含16个OTUs,细叶千斤拔根系样本含12个OTUs。综合每个物种的3个采样点结果,大叶千斤拔的Shannon多样性指数为1.80,细叶千斤拔则为1.13。以上结果表明大叶千斤拔根内丛枝菌根真菌种类较为丰富,但与细叶千斤拔比较差异无统计学意义(P>0.05)。
1.4 数据处理 采用Microsoft Excel 2017软件对数据进行处理和绘图。使用SPSS 22.0统计分析软件对大叶千斤拔和细叶千斤拔根内丛枝菌根真菌侵染率、孢子密度、菌丝密度等数据进行差异显著性检验(LSD法),使用Fisher确切概率法对大叶千斤拔与细叶千斤拔根内丛枝菌根真菌序列类群对应克隆数及不同科丛枝菌根真菌的差异显著性进行检验[26-27]。
表4 大叶千斤拔与细叶千斤拔根内丛枝 菌根真菌18S rRNA克隆文库

样品类型克隆数(个)RFLP条带类型数(个)OTU数(个)覆盖率(%)Shannon指数大叶千斤拔276481699.31.80细叶千斤拔282351298.61.13
2.3 系统发育分析与丛枝菌根真菌群落组成 对已获得23个序列类型中的代表序列进行系统发育分析,见图1,大叶千斤拔与细叶千斤拔根内丛枝菌根真菌种类分属于5个科,19个属;经Blast序列比对,仅6个可以鉴定到种(Bootstrap>85)。6个可鉴定到种的可操作分类单元中见表5,有1个优势类群(Rhizophagus fasciculatus),2个常见类群(Acaulospora spinosa、Rhizophagus intraradices),1个偶见类群(Glomus indicum),2个稀有类群(Claroideoglomus lamellosum、Glomus viscosum)。
与MaarjAM数据库比对,18个序列类群均可以划分为虚拟分子分类种(相似度>97%,见表5),且无分属于同一虚拟分子分类种的现象。通过构建系统发育树以及与虚拟分类分子种比对2种方法均未能对可操作分类单元成功鉴定的有5个OTUs。通过虚拟分子种的划分,将未能通过构建系统发育树鉴定到种的4个OTUs、且在大叶千斤拔与细叶千斤拔根内为常见类群的可操作分类单元进行虚拟分类(OTU5、OTU6、OTU9、OTU12)。通过MaarjAM数据库还可以获得对应虚拟分子分类种所处生态系统及生境的信息。在18个比对到虚拟分子分类种的序列类群中,6个序列类群所对应虚拟分子分类种所处生境为热带生态系统,包含7.89%的克隆子;7个虚拟分子分类种分布在亚热带生态系统,包含32.97%的克隆子;4个虚拟分子分类种分布在亚热带生态系统,包含41.40%的克隆子。
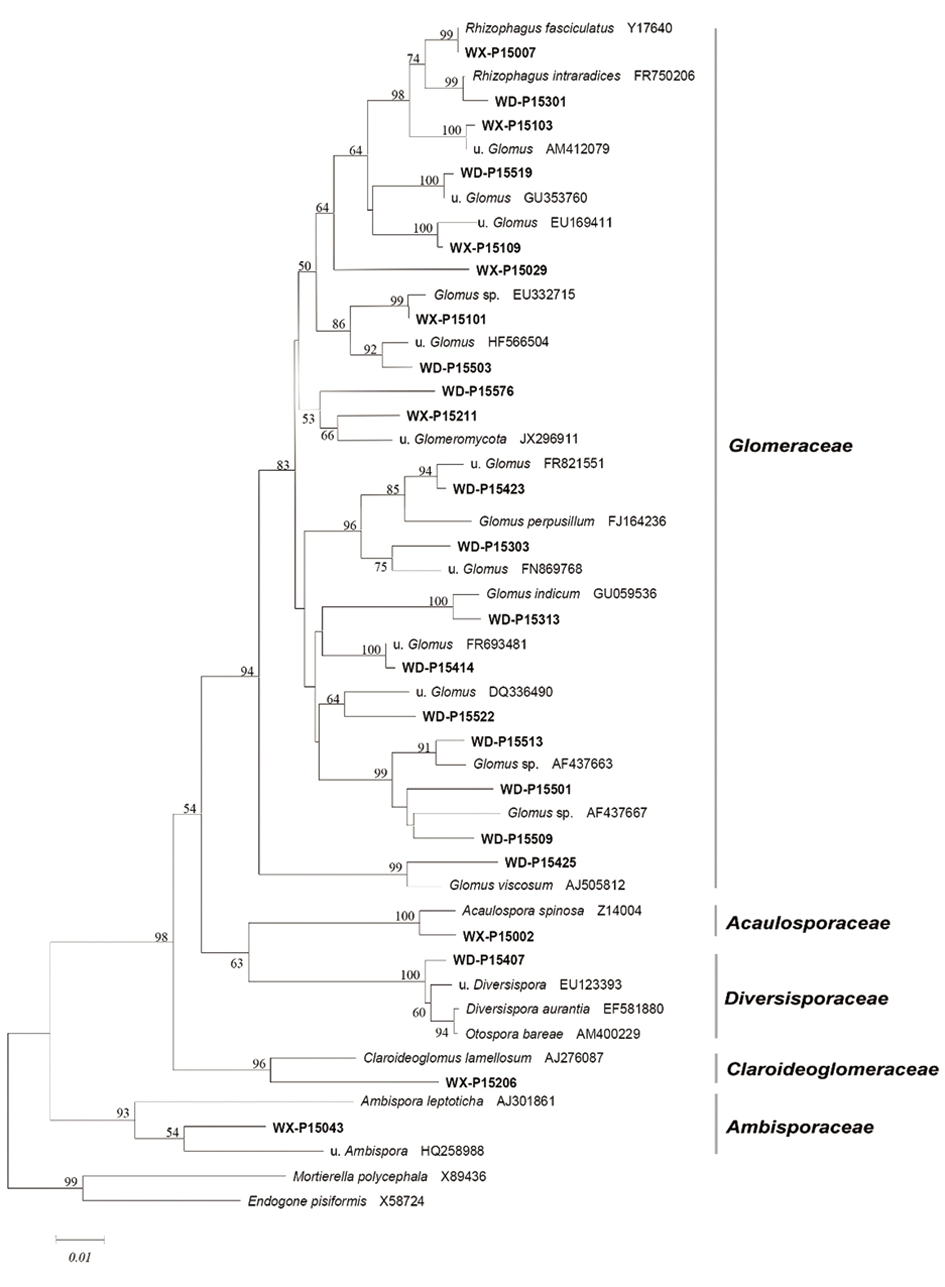
图1 大叶千斤拔与细叶千斤拔根内丛枝菌根真菌 18S rRNA序列的Neighbor-Joining系统发育树
表5 大叶千斤拔与细叶千斤拔根内丛枝菌根真菌种类

OTU类型序号OTU相关序列大叶千斤拔/细叶千斤拔的根内克隆数分子虚拟分类生长环境相关种重要值(%)1WX-P15043-/1---8.422WX-P15206-/1--Claroideoglomuslamellosum8.423WX-P15002-/43VTX00026亚热带田地Acaulosporaspinosa20.524WD-P1540721/-VTX00062亚热带草原-10.225WD-P1550327/11VTX00364亚热带落叶灌木林-36.746WX-P151010/21VTX00093亚热带重金属污染土壤-26.887WX-P1500744/136VTX00113-Rhizophagusfasciculatus57.808WD-P1530141/3VTX00100-Rhizophagusintraradices37.289WX-P151035/51VTX00280亚热带农业生态系统-21.6810WX-P15029-/1VTX00410--8.4211WX-P15109-/7VTX00268温带果园-8.9612WD-P1551923/-VTX00069--27.0613WD-P1550922/2---27.1514WD-P1551319/-VTX00121温带半野生大草原-18.3715WD-P1550119/----18.3716WX-P15211-/5VTX00182热带雨林-8.7817WD-P1557610/----9.2318WD-P153036/-VTX00419热带干旱森林-8.8719WD-P154233/-VTX00109热带草原-8.6020WD-P154144/-VTX00166亚热带常绿阔叶林-17.0321WD-P155226/-VTX00124热带雨林-17.2022WD-P1531325/-VTX00222温带高寒草甸Glomusindicum10.5723WD-P154251/-VTX00063亚热带半干旱地中海灌木丛Glomusviscosum8.42Total276/282

图2 大叶千斤拔(A)与细叶千斤拔(B)根内丛枝菌根真菌序列类型分布相对多度
2.4 大叶千斤拔与细叶千斤拔根内丛枝菌根真菌分布的差异 大叶千斤拔与细叶千斤拔根内丛枝菌根真菌分布相对多度见图2所示。所获得的23个序列类型在大叶千斤拔和细叶千斤拔根内的分布比较,差异有显著统计学意义(P<0.001),在分布种类和相对多度均有很大差别。在大叶千斤拔根内16个序列类型中,11个序列类型仅在大叶千斤拔根系样品中出现,相对多度最高的3个序列类型依次为OTU22(9.06%)、OTU12(8.33%)、OTU4(7.61%);在细叶千斤拔根内12个序列类型中,7个序列类型仅在细叶千斤拔根系样品中出现,相对多度最高的3个序列类型依次为OTU3(15.25%)、OTU6(7.45%)、OTU11(2.48%);OTU7(大叶千斤拔15.94%、细叶千斤拔48.23%)、OTU8(大叶千斤拔14.86%、细叶千斤拔1.06%)、OTU9(大叶千斤拔1.81%、细叶千斤拔18.09%)、OTU5(大叶千斤拔9.78%、细叶千斤拔3.90%)在2种样品中均有出现。
采用SPSS 20.0软件对数据进行分析处理,计量资料以(均数±标准差)表示,采用t检验;计数资料以(n,%)表示,采用χ2检验,以P<0.05表示差异具有统计学意义。
本文所获得的23个序列类群分属于5个科,Glomeraceae在大叶千斤拔和细叶千斤拔根内的相对多度均大于90%,是二者根内共有种类,占绝对优势。大叶千斤拔根内特有种类为Diversisporaceae,是偶见类群;细叶千斤拔根内特有种类为Acaulosporaceae、Ambisporaceae、Claroideoglomeraceae,前者为常见类群,后二者为稀有类群。
3 讨论
通过Nested-PCR、RFLP与克隆测序技术相结合,使用丛枝菌根真菌特异性引物进行两次扩增,尽可能全面地获得根内不可培养丛枝菌根真菌的群落组成情况,并从大叶千斤拔和细叶千斤拔根内获得23个OTUs,分属于5个科,其中Glomeraceae在大叶千斤拔和细叶千斤拔根内占绝对优势。由于Glomeraceae科丛枝菌根真菌可通过在根内产生泡囊结构储存脂类物质帮助菌丝生长及再侵染[28],因此Glomeraceae科的繁殖策略更适合在经常被扰动的生态系统中存活[29]。已有研究表明,宽叶千斤拔在接种Glomeraceae科Funneliformis mosseae和Glomus versiforme可显著促进植株生长和药用部位的产量[30]。23个序列类型中6个序列类型鉴定到种,其中5种丛枝菌根真菌也广泛存在于我国其他药用植物根际土壤中:A.spinosa在人参[31]、三七[32]、三角叶黄连[33]等9种药用植物根围土壤中获得;C.lamellosum则在石菖蒲[34]、薄荷[34]、喜树[35]、蒙古扁桃[36]等药用植物根围土壤中发现;R.intraradices则在半夏[37]、糯米团[34]、紫茉莉[38]、连香树[39]等13种药用植物根围土壤中获得;R.fasciculatus则在人参、五味子、地黄、盾叶薯蓣等21种药用植物根围土壤中获得[40];G.viscosum则在薯蓣、狗脊、南方红豆杉等5中药用植物根围土壤中获得[41];而G.indicum则未在我国已报道、分离丛枝菌根真菌的171中药用植物根围土壤中获得,但其在大叶千斤拔根内的相对多度较高,在筛选大叶千斤拔促生菌株时应给予重视。另外,接种R.intraradices在高温胁迫下可促进苍术根茎生物量的积累并显著影响根茎挥发油总量和挥发油主要成分[42],且可显著提高库页红景天的净光合速率、根茎生物量及成活率[43]。同时该菌株为大叶千斤拔和细叶千斤拔根内的常见类群,应积极考察其对千斤拔属植物的促生长和有效成分积累的作用,并关注该属其他菌株与千斤拔属植物的互作情况。
不可纯培养的丛枝菌根真菌的鉴定早期主要是从根际土壤分离孢子进行形态学种类划分,导致产孢数量少或不产孢的种类并没有被发现。随着分子生物学的发展,越来越多研究表明植物根系中分布的丛枝菌根真菌群落与土壤中分布的群落有很大差异[44]。由此,基于分子生物学技术对根内丛枝菌根真菌群落组成进行考察,所获的优势类群往往无法被鉴定到种的水平。利用MaarjAM数据库、基于18S rRNA基因序列将丛枝菌根真菌的序列类型进行虚拟分类,可以更充分地挖掘分子鉴定的数据,使未能鉴定到种的序列类型也能找到与之相对应的虚拟分类分子种,并发现其在全球范围内的分布特点和生态学功能。在所获得的23个OTUs中,仅有6个OTUs可以比对到已获得孢子的形态鉴定物种,剩下17个OTUs的分类信息则无法确认。但通过MaarjAM数据库比对,又获得13个OTUs对应的虚拟分类分子种,该数据库还提供虚拟分类分子种的各种相关信息,包括采样点的生态系统类型、植被类型、相关已发表文献等信息,可对分子种进行后续研究、分析。因此,大叶千斤拔和细叶千斤拔根系样品中的绝大多数真菌群落得以鉴定,并对其栖息环境的偏好性及其作用有了一定的了解。大叶千斤拔根内丛枝菌根真菌种类更倾向于分布在人为扰动较小的野生环境中,而细叶千斤拔根内的丛枝菌根真菌则倾向于分布在受人类活动影响的生态系统中。分子种OTU6(VTX00093)分离自亚热带重金属污染土壤,仅在细叶千斤拔根系中发现,表明该地土壤人为扰动因素较多。所处生境会直接影响根内丛枝菌根真菌群落组成,真菌种类又会直接影响与植物的互作结果[45]。喜树幼苗分别接种6种丛枝菌根真菌后[46],发现均对喜树碱的代谢有影响。与无菌根幼苗对比,除F.mosseae会引起喜树碱含量降低外,其他5种丛枝菌根真菌种类都显著提高了喜树碱的含量,且物种之间是存在显著差异的,还有丛枝菌根真菌对喜树幼苗喜树碱含量的影响有器官差异。因此,在千斤拔属植物种植时,应根据与之互作的根内菌落分布特征,选取具有相应栖息偏好的种类作为筛选促生菌株的候选。对根内丛枝菌根真菌群落组成的鉴定,有助于全面地了解该植物所处生境,解读更多利于植物生长的微环境变化。
此次研究中,探析组术后感染率为5.56%,住院时间为(4.0±1.1)天,对比组术后感染率为21.21%,住院时间为(7.8±3.4)天,差异均有统计学意义(P<0.05)。综上所述,妇产科患者围手术期应用感染防控护理可有效抑制感染发生率,可缩短其住院时间,对于加快其病情好转以及减轻其经济压力可发挥积极作用。
综上所述,本研究基于18S rRNA分子鉴定技术及MaarjAM数据库,全面地对大叶千斤拔与细叶千斤拔根内丛枝菌根真菌组成进行分析,结合丛枝菌根真菌在生态系统中的分布特点,有助于对这些缺乏形态学研究的丛枝菌根真菌种类的相应生态功能进行总结分析,为种植大叶千斤拔的选址提供有力地环境指标数据,并为筛选促生菌株提供依据。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].41卷.北京:科学出版社,1995:313.
[2]陈一,李开双,黄峰娇.千斤拔的镇痛和抗炎作用[J].广西医学,1993,15(2):77-79.
[3]任朝琴,戴先芝,刘圆.千斤拔药材资源开发与利用的调查报告[J].西南民族大学学报:自然科学版,2011,37(4):610-613.
[4]Cardillo G,Merlini L,Mondelli R.Natural chromenes-III:colouring matters of wars:the structure of flemingins A,B,C and homoflemingin[J].Tetrahedron,1968,24(1):497-510.
[5]Cheng S Y,Xie Y,Feng X L,et al.Study of the volatile constituents in Radix Flemingia macrophyllae and a substitute by gas chromatography-mass spectrometry and chemometric methods[J].Molecules,2012,17(12):14111-14125.
[6]Ko Y J,Lu T C,Kitanaka S,et al.Analgesic and anti-inflammatory activities of the aqueous extracts from three Flemingia species[J].Am J Chin Med,2010,38(3):625-638.
[7]Wang Y,Curtis-Long M J,Yuk H J,et al.Bacterial neuraminidase inhibitory effects of prenylated isoflavones from roots of Flemingia philippinensis[J].Bioorg Med Chem,2013,21(21):6398-6404.
[8]Ho H Y,Wu J B,Lin W C.Flemingia macrophylla extract ameliorates experimental osteoporosis in ovariectomized rats[J].Evidence-based Complementary and Alternative Medicine,2009,2011(18):752302.
[9]李昌松,张丽霞,赵俊凌,等.云南地区大叶千斤拔不同种质的异黄酮含量比较[J].中国现代中药,2011,13(10):30-32,42.
[10]管志斌,张丽霞,高微微.大叶千斤拔种子萌发特性研究[J].中国农学通报,2011,27(13):116-120.
[11]Jansa J,Smith F A,Smith S E.Are there benefits of simultaneous root colonization by different arbuscular mycorrhizal fungi?[J].New Phytologist,2008,177(3):779-789.
[12]姜攀,王明元.厦门市七种药用植物根围AM真菌的侵染率和多样性[J].生态学报,2012,32(13):4043-4051.
[13]郭巧生,程俐陶,刘作易.丛枝菌根真菌对半夏产量及化学成分的影响[J].中国中药杂志,2010,35(3):333-338.
[14]周加海,范继红.AM真菌对川黄柏幼苗生长及小檗碱含量的影响[J].北方园艺,2007,31(12):25-27.
[15]滕华容.AM真菌与施磷量对柴胡生长和化学成分交互效应的研究[D].咸阳:西北农林科技大学,2005.
[16]Hijri I,Zuzana Sykorová,Oehl F,et al.Communities of arbuscular mycorrhizal fungi in arable soils are not necessarily low in diversity[J].Molecular Ecology,2006,15(8):2277-2289.
[17]赵婧,贺学礼.河北省安国市药用植物AM真菌资源和分布研究[J].河北农业大学学报,2010,33(1),43-48.
[18]卢华正,沙丽清,王君,等.西双版纳热带季节雨林与橡胶林土壤呼吸的季节变化[J].应用生态学报,2009,20(10),2315-2322.
[19]Phillips JM,Hayman DS,1970.Improved procedures for clearing roots and staining parasitic and vesicular mycorrhizal fungi for rapid assessment of infection[J].Transaction of the British Mycological Society,55(1):158-161.
[20]周丽思,郭顺星.云南西双版纳野生与栽培绞股蓝根内丛枝菌根真菌的分子多样性[J].应用生态学报,2013,24(9):2503-2510.
[21]Jakobsen I,Abbott LK,Robosen AD.External hyphae of vesicular-arbuscular mycorrhizal fungi associated with Trifolium subterraneum L[J].New Phytologist,1992,120(3):371-380.
[22]Lee J,Lee S,Young JPW.Improved PCR primers for the detection and identification of arbuscular mycorrhizal fungi[J].FEMS Microbiology Ecology,2008,65(2):339-349.
[23]Simon L,Lévesque RC,Lalonde M.Identification of endomycorrhizal fungi colonizing roots by fluorescent single-strand conformation polymorphism-polymerase chain reaction[J].Applied and Environmental Microbiology,1993,59(12):4211-4215.
[24]Helgason T,Daniell TJ,Husband R,Fitter AH,Young JP.Ploughing up the wood-wide web?[J].Nature,1998,394(6692):431.
[25]Öpik M,Vanatoa A,Vanatoa E,et al.The online database MaarjAM reveals global and ecosystemic distribution patterns in arbuscular mycorrhizal fungi(Glomeromycota)[J].New Phytologist,2010,188(1):223-241.
[26]Toljander JF,Santos-González JC,Tehler A,Finlay RD.Community analysis of arbuscular mycorrhizal fungi and bacteria in the maize mycorrhizosphere in a long-term fertilization trial[J].FEMS Microbiology Ecology,2008,65(2):323-338.
[27]Heuer H,Smalla K.Evaluation of community-level catabolic profiling using BIOLOG GN microplates to study microbial community changes in potato phyllosphere[J].Journal of Microbiological Methods,1997,30(1):49-61.
[28]Pietikäinen A,Kytöviita MM,Husband R.,Young JP.Diversity and persistence of arbuscular mycorrhizas in a low-arctic meadow habitat[J].New Phytologist,2007,176(3):691-698.
[29]Brundrett M,Abbott LK,Jasper DA.Glomalean mycorrhizal fungi from tropical Australia.I.Comparison of the effectiveness and specificity of different isolation procedures[J].Mycorrhiza,1999,8(6):305-314.
[30]谭钜发,黄京华,扶蓉,等.接种AM真菌对四种药用植物生长的影响研究初报[J].中药材,2009,32(6),15-17.
[31]李香串.接种泡囊-丛枝菌根剂对人参产量的影响[J].中药材,2003,26(7):475-476.
[31]任嘉红,刘瑞祥,李云玲.三七丛枝菌根(AM)的研究[J].微生物学通报,2007,34(2):224-227.
[33]黄文丽,范昕建,严铸云,等.三角叶黄连丛枝菌根真菌的多样性研究[J].中草药,2012,35(5):689-693.
[34]姜攀,王明元,卢静婵.福建漳州常见药用植物根围的丛枝菌根真菌[J].菌物学报,2012,31(5):676-689.
[35]于洋,于涛,王洋,等.接种后共培养时间对丛枝菌根喜树幼苗喜树碱含量的影响[J].生态学报,2012,32(5):1371-1377.
[36]王琚钢.蒙古扁桃AMF多样性及AM提高蒙古扁桃抗旱机制研究[D].呼和浩特:内蒙古大学,2011.
[37]程俐陶,郭巧生,刘作易.栽培及野生半夏丛枝菌根研究[J].中国中药杂志,2010,35(4):405-410.
[38]王虹,李莺,赵丽莉.VA菌根真菌对紫茉莉生长的影响[J].陕西农业科学,1999,45(1):22-23,41.
[39]王森,唐明,牛振川,等.山西历山珍稀药用植物AM真菌资源与土壤因子的关系[J].西北植物学报,2008,28(2):0355-0361.
[40]米芳珍.商洛地区8种药用植物VA菌根真菌的资源调查[J].山西林业科技,2012,41(5):37-39.
[41]赵金莉,程学谦,顾晓阳,等.河北安国新“八大祁药”根际AM真菌与土壤因子的关系[J].河南农业科学,2012,41(6):87-91.
[42]张霁,刘大会,郭兰萍,等.不同温度下丛枝菌根对苍术根茎生物量和挥发油的影响[J].中草药,2011,42(2):372-375.
[43]李熙英,黄世臣.丛枝菌菌根对1年生高山红景天植株生长的影响[J].林业科技,2005,33(3):25-27.
[44]Öpik M,Metsis M,Daniell TJ,Zobel M,Moora M.Large-scale parallel 454 sequencing reveals host ecological group speci city of arbuscular mycorrhizal fungi in a boreonemoral forest[J].New Phytologist,2009,184(2):424-437.
city of arbuscular mycorrhizal fungi in a boreonemoral forest[J].New Phytologist,2009,184(2):424-437.
[45]Treseder KK,Cross A.Global distributions of arbuscular mycorrhizal fungi[J].Ecosystems,2006,9(2):305-316.
[46]赵昕.丛枝菌根真菌对喜树幼苗的接种效应[D].哈尔滨:东北林业大学,2006.
Identification of Arbuscular Mycorrhizal Fungi of Flemingia macrophylla and Flemingia lineata in Yunnan, Based on 18S rRNA Sequences
文章来源:《世界睡眠医学杂志》 网址: http://www.sjsmyxzz.cn/qikandaodu/2020/0522/361.html

