现在的位置:主页 > 期刊导读 >
丹参F3′5′H基因克隆及其序列分析
【作者】网站采编【关键词】【摘要】花色是植物在花期的一个表现性状,主要由存在于液泡中的色素物质决定 [1-2] 。这些色素主要包括类黄酮(Flavonoids)、类胡萝卜素(Carotenoids)和甜菜色素(Betalains)。其中,类黄酮色素是植物
花色是植物在花期的一个表现性状,主要由存在于液泡中的色素物质决定[1-2]。这些色素主要包括类黄酮(Flavonoids)、类胡萝卜素(Carotenoids)和甜菜色素(Betalains)。其中,类黄酮色素是植物中最常见的调控花色的色素,而花色素苷是类黄酮中一类主要的色素,它控制植物花的红、蓝、紫等颜色[3]。花瓣中类黄酮化合物的羟基化模式决定了花瓣呈现的颜色,而类黄酮的羟基化过程由细胞色素P450(Cytochromes P450,CYP450)负责催化完成[4]。
在高等植物中,类黄酮-3′,5′-羟基化酶(Flavonoid-3′,5′-hydroxylase,F3′5′H)和类黄酮-3′-羟基化酶(Flavonoid-3′-hydroxylase,F3′H)是催化二氢黄酮到二氢黄酮醇的关键酶,它们催化花青素生物合成途径中的羟基化过程。其中,F3′5′H催化花青素B环3′和5′位置的羟基化反应[5]。这两类细胞色素P450都属于CYP75亚家族[6],是催化二氢黄酮到二氢黄酮醇的关键酶[7]。花青素B环上的羟基数目影响着花的颜色,羟基数量越多蓝色越深[4]。F3′5′H 在番茄(Solanum lycopersicum)[8]和瓜叶菊(Senecio cruentus)[9]等多种植物中已被克隆分离。在矮牵牛(Petunia hybrida)中异源表达蔓长春花(Vinca major)F3′5′H 基因使红色矮牵牛的花瓣变为紫色[10]。在葡萄(Vitis vinifera L.cv Shiraz)中,VvF3′5′H 在红葡萄的果皮中高丰度表达,而在白葡萄的果皮中表达量极低[11]。在一些观赏植物如玫瑰和康乃馨中,如果F3′5′H 不表达,将导致不能形成蓝色和紫色花。通过在玫瑰和康乃馨中表达F3′5′H ,产生了蓝色玫瑰和蓝色康乃馨[12],这些蓝色花卉被广泛运用于商业化生产。
2.1.4 其他物理保鲜方式 辐照保鲜是利用原子能射线释放的能量对食品进行杀菌和杀虫,并干扰果蔬生理代谢来延长保藏期。根据FAO/IAEA/WHO联合专家委员会的标准,采用10 kGy的射线辐照食品在毒理学上不存在危险,因此常用10 kGy以下的剂量来控制果蔬的采后病害。例如,Marquenie等[15]采用不同剂量的γ射线辐照处理草莓果实,发现各处理均可以降低果实采后的腐烂率,且最适宜的辐照剂量为2.5~3.5 kGy。而在杨梅的辐照保鲜中,杨梅对γ射线的忍受力较弱,剂量仅为0.1~0.3 kGy [16]。
丹参(Salvia miltiorrhiza Bunge)属于双子叶唇形科鼠尾草属药用植物,异花传粉。自然界中丹参的花有白花、紫花或白色和紫色的混杂色(浅紫色)。在丹参基因组中,14个参与黄酮生物合成途径的酶基因已被鉴定[13],其中,丹参F3′5′H(SmF3′5′H)是一个单拷贝基因。为了进一步验证SmF3′5′H的功能,我们在紫花丹参99-3品系中,分别克隆了SmF3′5′H的编码区序列(cDNA)和基因组序列(gDNA);并在栽培的白花丹参和紫花丹参(包含浅紫色花丹参)中,分别克隆了SmF3′5′H的cDNA序列。进一步对SmF3′5′H进行序列测定和比对分析,统计并筛选到一个与丹参花色(紫花和白花)相关的SNP位点。同时,利用毛状根遗传转化方法[14]获得了该基因的过表达转基因毛状根株系。本研究还分析了SmF3′5′H的表达谱,并预测了SmF3′5′H理化性质和蛋白特性,这些结果表明,SmF3′5′H是一个调控丹参花色的关键基因,为丹参花色研究奠定基础。
由于英、汉语言的差异,有些修辞格难以做到在中文中找到对应的修辞格,例如头韵。此时,为了实现与目标语读者交流的目的,放弃修辞格而直译是可以接受的。
1 仪器与试剂
1.1 仪器 冷冻高速离心机(赛默飞世尔科技(中国)有限公司,型号:Legend Micro 17R型),涡旋仪(赛洛捷克公司,美国,型号:1400059999型),96孔梯度PCR仪(赛默飞世尔科(中国)有限公司,型号:2990234871型),DYY-8C型电泳仪(伯乐生命医学产品(上海)有限公司,型号:Power Pac型)。
1.2 试剂 RNAprep Pure植物多糖多酚总RNA提取试剂盒(天根生化科技(北京)有限公司,批号:R6313),PrimeScriptTM II 1st strand cDNA合成试剂盒(普洛麦格(北京)生物技术有限公司,批号:0000375832);10×PCR Buffer与pyrobest DNA聚合酶(宝日医生物技术(北京)有限公司,货号:R005A)。pEASY-Blunt Zero Cloning试剂盒(北京全式金生物公司,型号:CB501-02),质粒小提试剂盒(天根生化科技(北京)有限公司,货号:DP103-03),普通琼脂糖凝胶DNA回收试剂盒(天根生化科技(北京)有限公司,货号:DP209-03),SYBR Premix Ex TaqTM(宝日医生物技术(北京)有限公司,货号:RR820A)。
1.3 实验材料 丹参99-3植株分别采自中国医学科学院药用植物研究所试验地和本实验的组培苗。其他紫花和白花以及浅紫色花的丹参花序分别采自中国医学科学院药用植物研究所试验地和药用植物园。采集样品的花色见图1所示。同时采集了2年生的紫花丹参的根、茎、叶、花。
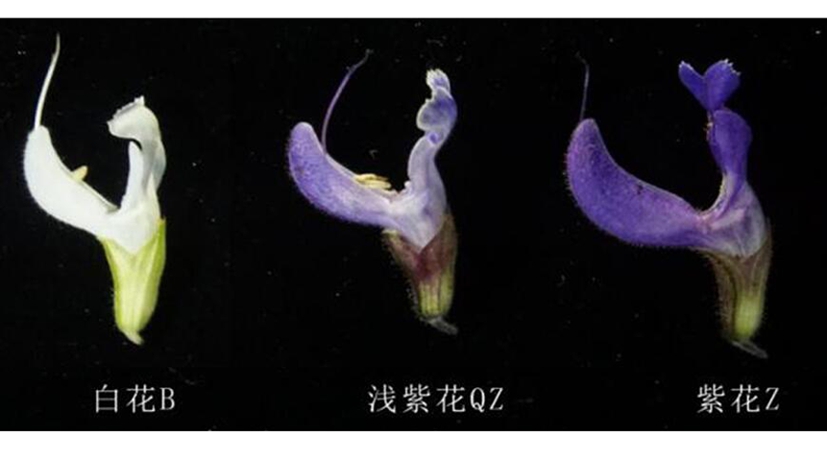
图1 丹参花色比较
2 方法与结果
2.5 序列分析 使用DNAMAN将测序获得的序列进行多序列比对,得到差异位点分布信息,筛选在紫花丹参和白花丹参样品中稳定变化的SNP位点。将克隆得到的正确丹参序列在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上BLAST搜索其他植物中的同源性序列,使用MEGA 6进行Clustal W多序列比对,并采用邻接法(Neighbor-joining method)构建系统进化树。使用ExPASy(https://web.expasy.org/compute_pi/)对全长氨基酸序列进行理化性质分析。使用Interpro(http://www.ebi.ac.uk/interpro/search/)进行保守结构域预测。同时,使用Swiss-Model(https://swissmodel.expasy.org/interactive/)进行三维同源建模。
该电机为4极12槽结构,按式(5)计算出斜槽角度为30°。由于电机的空间限制,定子铁芯的长度只有不到13 mm,斜槽之后嵌线会难度增加,所以槽满率必须控制在较低的一个范围,嵌线困难时可考虑采取分段槽契。
表1 引物序列
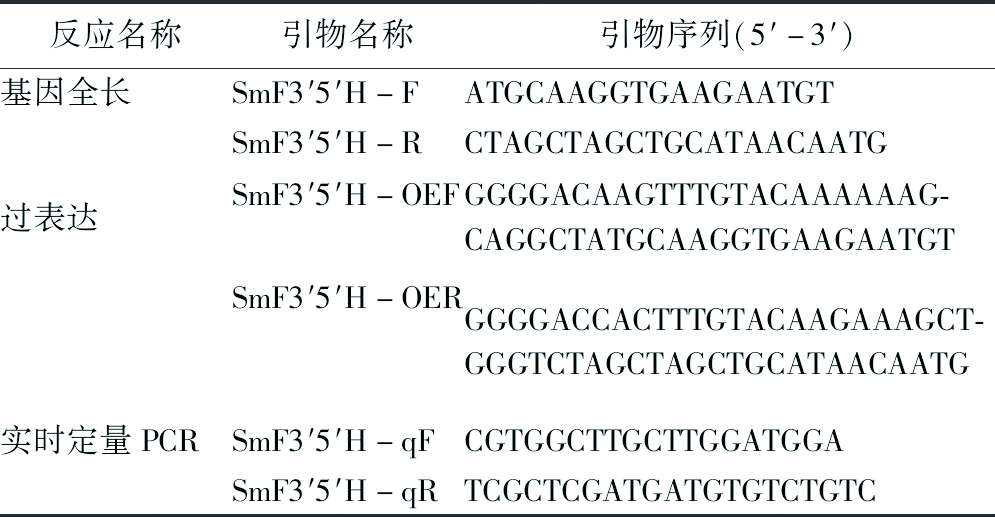
反应名称引物名称引物序列(5′-3′)基因全长SmF3′5′H-FATGCAAGGTGAAGAATGTSmF3′5′H-RCTAGCTAGCTGCATAACAATG过表达SmF3′5′H-OEFGGGGACAAGTTTGTACAAAAAAG-CAGGCTATGCAAGGTGAAGAATGTSmF3′5′H-OERGGGGACCACTTTGTACAAGAAAGCT-GGGTCTAGCTAGCTGCATAACAATG实时定量PCRSmF3′5′H-qFCGTGGCTTGCTTGGATGGASmF3′5′H-qRTCGCTCGATGATGTGTCTGTC
据业内人士介绍,水利基础设施建设投资步伐的加快将催生一批适合水利施工的专用机械,大型水利施工中的成套设备、水下抢险施工中的遥控机器人等是集机械、电子和自动化控制等一系列技术于一体的集成系统,将促进工程机械和专用水利施工机械智能化程度的快速提高。与此同时,在大型水利项目建设和农田水利改造过程中,挖掘、铲运和平土等工作将促进挖掘机、推土机、各类钻机和装载机等设备的需求增加,同时对其衍生品的专业化程度提出更高要求,也将带动工程机械配件行业的发展。
2.1 RNA提取与质量检测 将采得样品每株分别清洗去除杂质后,用吸水纸吸干样品表面水分,用铝箔纸包装并编号,立即置于液氮中速冻,并移至-80 ℃冰箱中保存备用。取干净的植物材料(50~100 mg),液氮研磨至均匀粉末,采用天根植物多糖多酚总RNA提取试剂盒提取总RNA。取1 μL RNase-Free ddH2O于Nanodrop 2000 Spectrophotometer仪器上设立空白对照,取1 μL RNA溶液进行浓度检测,获得RNA溶液浓度、OD260/OD280、OD260/OD230的数值。取2 μL RNA溶液和1 μL上样缓冲液(Loading Buffer),补充3 μL RNase-Free ddH2O,混匀为6 μL样品,制备1%浓度的琼脂糖凝胶,进行琼脂糖凝胶电泳检测,确认RNA完整性及质量。
准时制(JIT),可概括为“任何时间、任何地点、任何事情”,都可以及时解决和处理,以达到零时间、零距离的高效作业模式。审批平台可以引入此理论在审批业务流程的设计和模型的架构当中,以实现审批的高效、便捷。具体JIT模式的优势见图1。
2.9.1 SmF3′5′H全长克隆及序列比对 以紫花丹参99-3株系的cDNA和基因组DNA为模板,分别克隆得到了SmF3′5′H的cDNA的完整ORF和基因组序列。该基因cDNA全长为1 551 bp,编码516个氨基酸;该基因的基因组序列全长1 634 bp,经与cDNA序列比对分析发现,该基因的基因组序列(gDNA)中含有一段长为83 bp的内含子序列。见图2。在采集的42株丹参样品中,17株为白花丹参,标记为B(白花);25株为紫花丹参,标记为Z(紫花),其中3株为浅紫花丹参,标记为QZ(浅紫花)。
2.9 结果
2.7 侵染丹参叶片 取生长旺盛的丹参组培苗幼嫩叶片,剪切成0.5 cm2大小的叶盘于MS培养基25 ℃预培养2 d。将转化得到发根农杆菌ACCC10060 28 ℃培养于含50 mg/L Spec+50 mg/L Rif(利福平)的液体YEB培养基,28 ℃振荡培养至OD600达到0.4~0.6,使用MS培养基重悬菌体,混合侵染后置于MS平板上,25 ℃黑暗条件下共培养48~72 h。将共培养的叶盘分别用无菌水和含500 mg/L Car(羧苄青霉素)的无菌水中洗干净后,置于含500 mg/L Car+50 mg/L Kan的MS平板上,25 ℃黑暗条件下筛选培养,选择长势良好的毛状根,待其生长至2.0~3.0 cm后切下,置于含200 mg/L Car+15 mg/L Kan+0.1 mg/L IAA的6,7-V固体培养基上刺激一周后转接至不含IAA的固体培养基,待长出较多侧根后,使用荧光显微镜检测载体质粒含有的标签蛋白——绿色荧光蛋白(GFP)的表达情况,判断转基因毛状根是否为阳性株系。将选择3株阳性株系标记为ZC-OE-1、ZC-OE-2和ZC-OE-3转接至6,7-V液体培养基中继续培养。
2.8 丹参F3′5′H表达分析 取液体培养1个月的只转化了空载体的对照株系(PK)和过表达株系(OE)毛状根,以及采集的丹参根、茎、叶、花器官,分别提取总RNA,再将这些RNA反转录为cDNA。挑选SmF3′5′H基因特异性片段设计实时定量PCR(qRT-PCR)引物:SmF3′5′H-qF/R,引物序列见表1。以丹参SmACTIN(HM231319.1)作为内参基因,制备qRT-PCR体系:2×SYBR Premix Ex Taq II 2.5 μL,cDNA模板1 μL,引物各1 μL,RNase-free ddH2O 4.5 μL。qPCR反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。65~95 ℃时做熔解曲线,收集Ct值,以2-△△Ct方法[15]计算不同样品间该基因相对表达量。
2.4 序列处理 获得的测序结果为序列的正向测序结果和反向测序结果,原始数据均以AB1格式和SEQ格式储存。原始数据中,包含低质量的接头片段、低质量碱基和未测出的碱基。为排除这些干扰,需去掉这些不可读的序列信息,获得质量可靠的测序结果。使用Codoncode处理原始数据,包含以下步骤:1)将正反两条序列的AB1文件打开,拼接获得Contig序列。2)当正反两条序列所得的测序结果不一致时,如含低质量碱基和未测出的碱基,则以测序质量高的一条测序结果为准。3)当同一条序列在某一位点出现套峰,则以峰高、峰锐的峰图为准。
2.2 cDNA全长克隆 以提取的总RNA为模板,通过PrimeScriptTM II 1st strand cDNA试剂盒反转录得到cDNA。根据丹参基因组数据,选取F3′5′H基因的开放阅读框(Open Reading Frame,ORF)区域,设计基因全长扩增引物:SmF3′5′H-F/R,引物序列见表1。以cDNA为模板配制PCR反应体系,加入1 μL cDNA,0.1 μL Pyrobest DNA聚合酶,2.5 μL 10×Buffer和特异性基因全长扩增引物SmF3′5′H-F/R各0.1 μL,补充ddH2O至25 μL。设置PCR反应条件为:预变性95 ℃ 30 s;变性94 ℃ 30 s,退火56 ℃ 30 s,延伸72 ℃ 2 min,30个循环;72 ℃ 10 min;10 ℃保温。将全部PCR产物通过凝胶电泳分离,将回收产物按照pEASY-Blunt Zero试剂盒提供的方法连接pEASY载体。取1 μL pEASY载体与4 μL回收产物混合,室温反应5 min,将连接产物加入50 μL Trans-T1感受态细胞混合,冰浴30 min后,42 ℃水浴热激90 s,再置于冰上孵育2 min,加入250 μL LB液体培养基,在150 r/min 37 ℃条件下恢复培养1 h。取200 μL转化的感受态细胞的菌液涂布于含50 mg/L Amp(氨苄青霉素)的LB固体培养基进行筛选培养。待生长出菌落后,挑单克隆进行菌落PCR验证,取阳性菌株送中国农业科学院进行Sanger测序。
在2010年《文艺研究》第3期,学者王彬彬发表了《汪晖〈反抗绝望——鲁迅及其文学世界〉的学风问题》,指出在学者汪晖的这一著作中存在着以下几种抄袭剽窃问题:
2.6 构建过表达载体 将2.2中测序正确的阳性菌株加入10 μL LB液体培养基中摇菌,按照质粒小提试剂盒的方法,取过夜培养的菌液提取质粒。设计SmF3′5′H基因全长的过表达(Over-expression,OE)引物,根据Gateway原理在引物前添加attB序列,所用引物名称为:SmF3′5′H-OEF/R,引物序列见表1。以重组质粒pEASY-SmF3′5′H为模板,使用SmF3′5′H-OEF/R引物进行PCR扩增。将PCR产物回收,再将回收产物进行BP反应,BP反应体系:25 ng attB-PCR回收产物,75 ng pDONR221入门载体,1 μL LR clonase II enzyme,补充ddH2O至5 μL。将其反应连接产物转化DH5α感受态细胞,用含50 mg/L Kan(卡那霉素)的LB固体培养基筛选培养,回收pDONR221-SmF3′5′H重组质粒进行LR反应;LR反应体系:75 ng pDONR221-SmF3′5′H回收产物,75 ng pK7WG2D受体载体,1 μL LR clonase II enzyme,补充ddH2O至5 μL。反应连接产物转入DH5α感受态细胞,取200 μL菌液涂布于含50 mg/L Spec(壮观霉素)的LB固体培养基筛选培养,菌落PCR检测后选择阳性菌株送公司测序;取测序正确的克隆提取重组质粒pK7WG2D-SmF3′5′H,将重组质粒(pK7WG2D-SmF3′5′H)和空载体(pK7WG2D)分别转入发根农杆菌ACCC10060中,分别获得SmF3′5′H的过表达毛状根株系(ZC-OE)和对照株系(ZC-pk-OE)。

图2 SmF3′5′H cDNA序列与gDNA序列比对结果

图3 白花丹参和紫花丹参SmF3′5′H的多序列比对结果
在紫花丹参和白花丹参F3′5′H基因序列的1 230 bp处存在一个与丹参花色相关的SNP位点,见图3所示。我们发现,在紫花丹参中,该处的碱基为C;在白花丹参中,该处碱基为T;在浅紫色花丹参中,该处的碱基为C或T。经仔细核对序列的测序峰图,发现在浅紫色花丹参中,该位点处都为C/T双峰。见图4。依据碱基相应的峰高情况选择此处位点对应的碱基,所以,我们发现在三株浅紫花丹参中,有两株丹参在此位点的碱基为C,另一株浅紫花丹参此位点的碱基为T。见图3。因为丹参为常异花授粉植物,推测浅紫色花丹参可能与白花丹参和紫花丹参的天然杂交有关,因此,该位点在浅紫色花丹参中为C或T。除此位点外的其他SNP位点均不与丹参花色——白花、紫花和浅紫花这一性状具有明显的相关性,见图3中所示的1 189 bp处的A/G这一SNP位点。
2.9.2 SmF3′5′H序列分析和三维同源建模 利用ExPASy对SmF3′5′H蛋白质序列的理化性质进行预测分析,结果显示SmF3′5′H的蛋白质相对分子质量为57.4 kDa,等电点为8.77。根据Interpro预测结果,SmF3′5′H属于CYP450超基因家族,Interpro数据库中SmF3′5′H同源序列的序号为IPR002401。预测分析发现,在SmF3′5′H氨基酸序列的7~29位点处有跨膜螺旋结构,1~7位点处为该蛋白质的细胞质结构域,29~516位点为非细胞质结构域,见图5所示。SmF3′5′H蛋白质序列的三维同源建模以Swiss-Model数据库中的5ylw.1.A蛋白质为模板,SmF3′5′H蛋白质序列与模板蛋白质序列相似度为33.62%。见图6。
2.9.3 F3′5′H系统进化分析 将SmF3′5′H氨基酸序列与其他植物F3′5′H氨基酸序列进行系统进化分析。这些植物包括棉花(Gossypium hirsutum)、葡萄(Vitis vinifera)、大豆(Glycine max)、番茄(Solanum tuberosum)、矮牵牛(Petunia x hybrida)、蔓长春花(Vinca major)、长春花(Catharanthus roseus)、洋桔梗(Eustoma grandiflorom)、夏堇(Torenia hybrid cultivar)、美女樱(Glandularia x hybrida)。选择以上植物的F3′5′H氨基酸序列均来自于Genbank数据库。绘制F3′5′H的进化树见图7所示,SmF3′5′H与美女樱和夏堇中的F3′5′H亲缘关系较近。

图4 SmF3′5′H基因1 230 bp的碱基测序双峰图
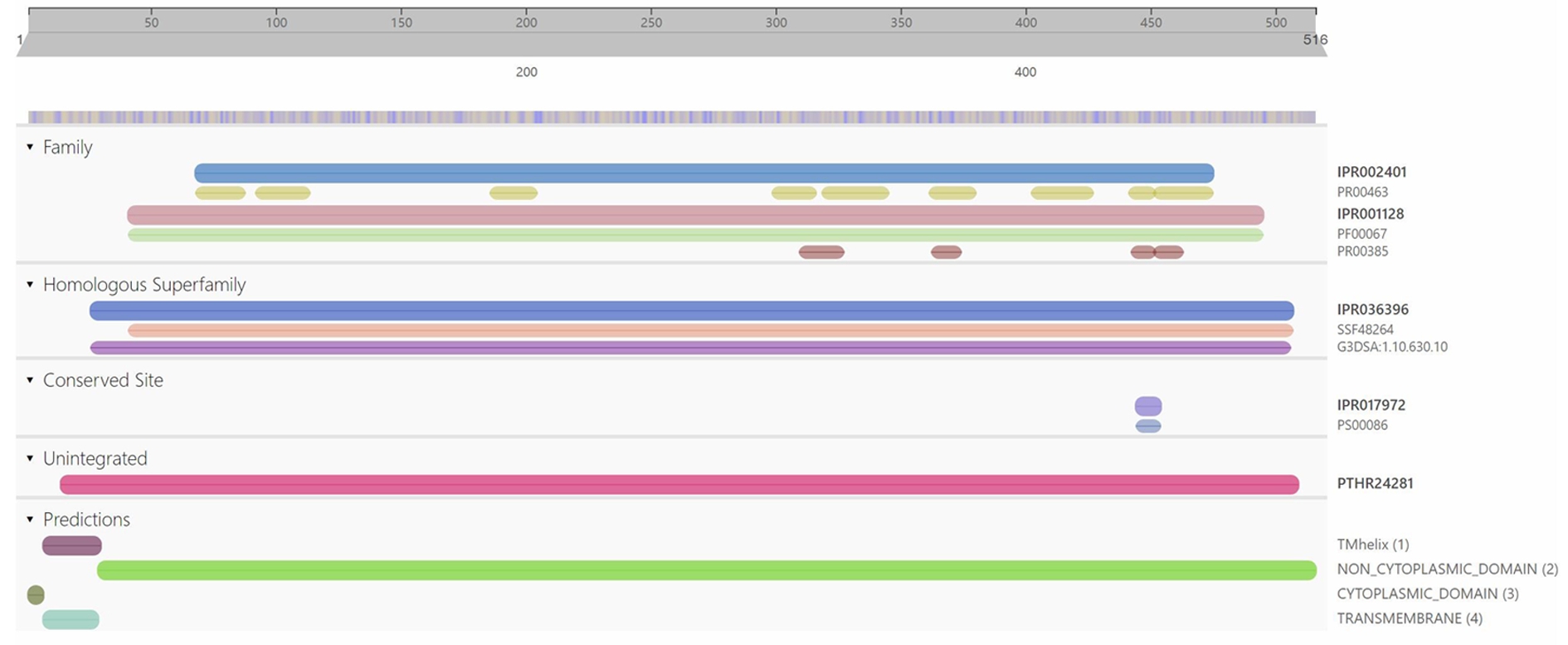
图5 SmF3′5′H蛋白质序列保守结构域分析
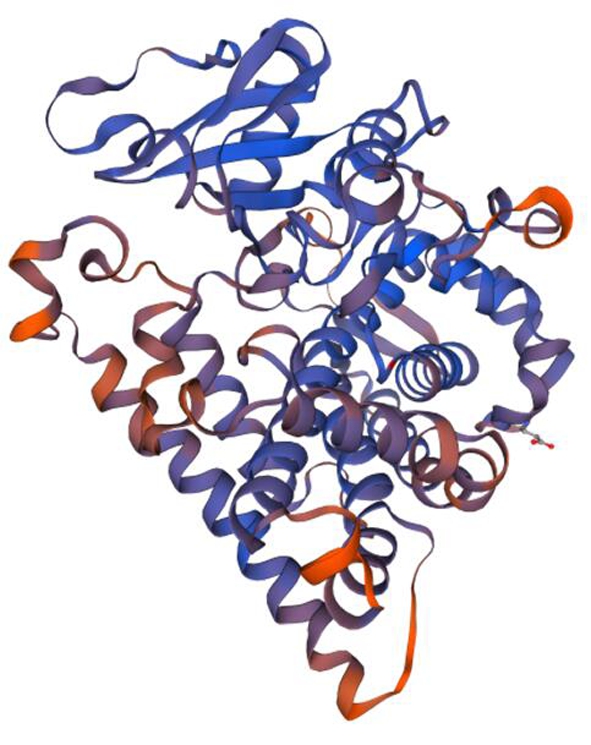
图6 SmF3′5′H蛋白质三维模型预测
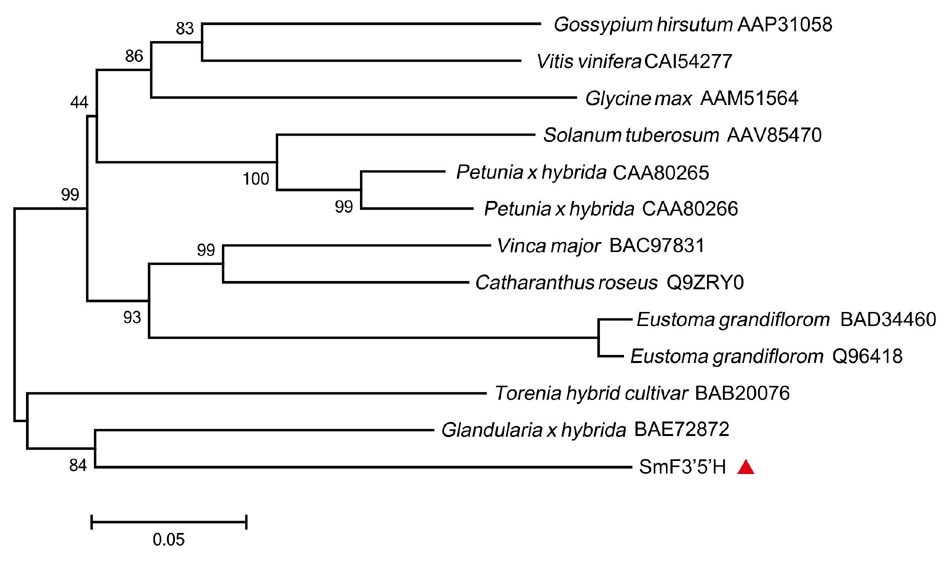
图7 F3′5′H系统进化分析
2.9.4 SmF3′5′H过表达的转基因毛状根获得 将含有SmF3′5′H基因的质粒转入发根农杆菌(ACCC10060)最终获得转基因毛状根,见图8a。使用荧光显微镜检测毛状根中的GFP蛋白的绿色荧光情况,发现所获得的转基因毛状根有绿色荧光,见图8b,表明转基因毛状根构建成功。利用qRT-PCR方法检测了不同转基因毛状根株系中SmF3′5′H的相对表达量,与对照株系相比,发现该基因的表达水平在ZC-OE-2过表达株系显著增高,而在ZC-OE-3株系中略有增高,在ZC-OE-1中该基因的表达水平与对照株系相近。见图9。这个实验结果表明,我们初步获得了SmF3′5′H过表达转基因毛状根株系ZC-OE-2,可用于后续基因功能研究。
2.9.5 SmF3′5′H的表达谱分析 利用SmF3′5′H的qRT-PCR的引物,以2年生丹参的根、茎、叶、花的cDNA为模板,检测了该基因在丹参不同器官中的表达特点。结果表明,该基因在丹参花(zc-F)中显著高丰度表达,在茎(zc-S)中的表达量次之,在根(zc-R)和叶(zc-L)中表达量较低。见图10。

图8 SmF3′5′H过表达转基因毛状根及荧光显微镜视图
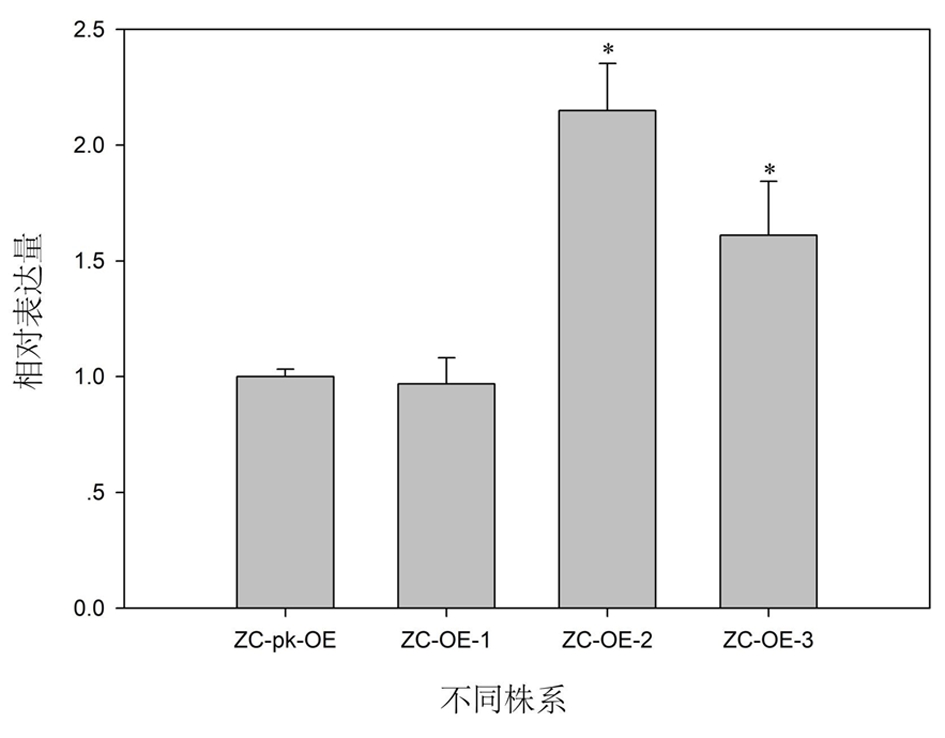
图9 SmF3′5′H过表达转基因毛状根株系中该基因的相对表达量
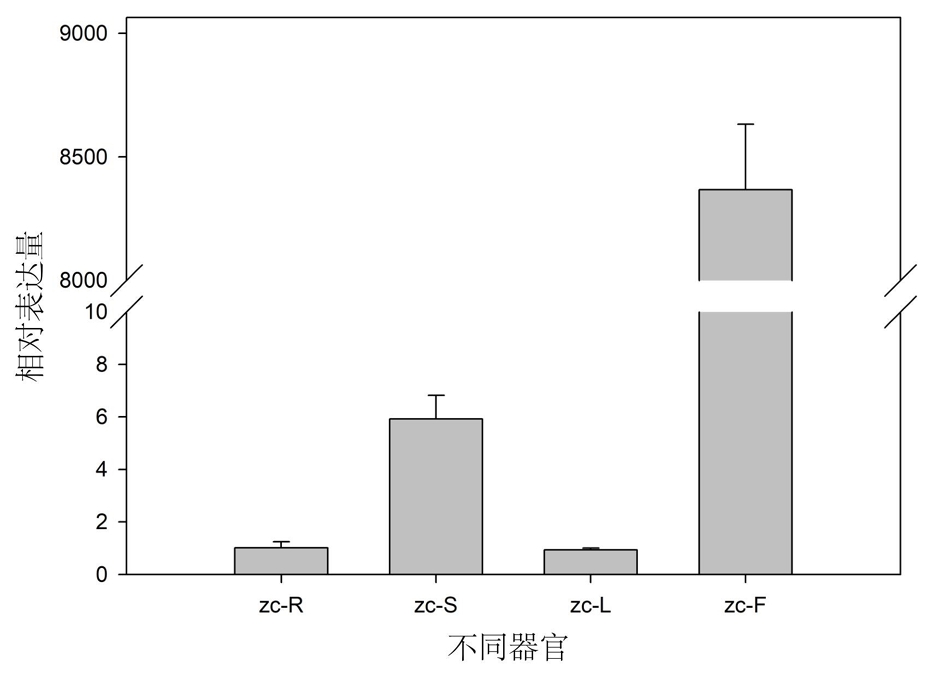
图10 SmF3′5′H在丹参不同器官中的相对表达量
3 讨论
由于F3′5′H参与植物花青素的生物合成过程,所以对植物花色形成具有关键作用。研究F3′5′H基因及其编码蛋白质的理化特性和功能,有助于阐明植物花色的形成机制。本研究从丹参中克隆到SmF3′5′H基因的cDNA和gDNA序列,并发现该基因序列中只含有一个内含子,其编码区包含2个外显子。见图2。在丹参基因组[16]中,该基因是一个单拷贝基因,这与矮牵牛中有2个基因(Hf1和Hf2)编码F3′5′H不同[17],并且矮牵牛这2个基因功能不同[18-19]。由此推测SmF3′5′H在决定丹参花色性状方面发挥关键作用。在分析采自试验地里的42株丹参样品的SmF3′5′H cDNA序列时发现在1 230 bp处,有一个SNP位点与丹参的白花和紫花性状具有相关性,见图3;并且在3株浅紫色花丹参中,发现此位点处碱基的峰图是C/T双峰,见图4,推测这可能是由于这些丹参在试验地里生长时发生过自然杂交,子代分离从而导致花色分离的现象。将从白花丹参中克隆获得的SmF3′5′H与GenBank中的SmF3′5′H(MH447665.1)经过比对发现,这两条序列仅存在2个碱基差异,分别存在于1 189 bp和1 230 bp处。其中,GenBank中SmF3′5′H与克隆到的白花丹参SmF3′5′H的1 189 bp处碱基位点分别为G和A,这样的碱基差异引起相应的SmF3′5′H 397氨基酸位点从天冬氨酸(D)到天冬酰胺(N)的改变;而这2个SmF3′5′H(MH447665.1和本研究克隆的SmF3′5′H)在1 230 bp处碱基分别为C和T(序列比对结果未显示),由此表明SmF3′5′H在丹参不同个体的基因组中其序列相对较为保守;且GenBank中的丹参F3′5′H序列可能从紫花丹参中分离获得。大多数类黄酮生物合成酶被认为是可溶性蛋白,固定于内质网膜上发挥代谢引导作用,使黄酮类化合物的合成代谢途径更高效[20-21]。SmF3′5′H属于CYP450,而CYP450主要分布在内质网和线粒体内膜上,作为一种末端加氧酶,参与了生物体内的多种代谢物的生物合成过程。生物信息学预测结果表明,SmF3′5′H蛋白N端具有跨膜结构域,见图5,表明它可能是个膜蛋白。qRT-PCR检测到SmF3′5′H在丹参花中显著性高表达,见图10,暗示该基因主要参与花中类黄酮化合物的生物合成途径。本研究还获得了过表达SmF3′5′H的转基因毛状根,这为进一步研究该基因的功能奠定基础。随着本草基因组学研究[22-23]的不断深入,多组学技术的不断发展和完善,极大地促进了丹参作为药用模式植物[24]的功能基因组学研究,因此,开展SmF3′5′H调节丹参花色形成机制的研究,具有重要理论意义;同时,我们发现了一个与丹参花色性状紧密相关的SNP位点,该位点为后续开展基于花色的丹参品种鉴定及优良种质选育提供靶基因。
[1]赵云鹏,陈发棣,郭维明.观赏植物花色基因工程研究进展[J].植物学通报,2003,20(1):51-58.
[2]姜卫兵,庄猛,韩浩章,等.彩叶植物呈色机理及光合特性研究进展[J].园艺学报,2005,32(2):352-358.
[3]Shimada S,Takahashi K,Sato Y,et al.Dihydroflavonol 4-reductase cDNA from non-anthocyanin-producing species in the Caryophyllales[J].Plant Cell Physiology,2004,45(9):1290-1298.
[4]Tanaka Y,Brugliera F.Flower colour and cytochromes P450[J].Phlilosophical Transations of The Royal Society B,2013,368:20120432.
[5]Winkel-Shirley B.Flavonoid Biosynthesis.A colorful model for genetics,biochemistry,cell biology,and biotechnology[J].Plant Physiology,2001,126(2):485-493.
[6]Wang Y S,Xu Y J,Gao L P,et al.Functional analysis of flavonoid 3′,5′-hydroxylase from tea plant(Camellia sinensis):critical role in the accumulation of catechins[J].BMC Plant Biology,2014,14:347.
[7]Grotewold E.The genetics and biochemistry of floral pigments[J].The Annual Review of Plant Biology,2006,57:761-780.
[8]Olsen K M,Hehn A,Jugdé H,et al.Identification and characterisation of CYP75A31,a new flavonoid 3′5′-hydroxylase,isolated from Solanum lycopersicum[J].BMC Plant Biology,2010,10:21.
[9]He H,Ke H,Keting H,et al.Flower colour modification of Chrysanthemum by suppression of F3′H and overexpression of the exogenous Senecio cruentus F3′5′H gene[J].PLoS One,2013,8(11):e74395.
[10]Mori S,Kobayashi H,Hoshi Y,et al.Heterologous expression of the flavonoid 3′,5′-hydroxylase gene of Vinca major alters flower color in transgenic Petunia hybrida[J].Plant Cell Reports,2004,22(6):415-421.
[11]Bogs J,Ebadi A,McDavid D,et al.Identification of the flavonoid hydroxylases from Grapevine and their regulation during fruit development[J].Plant Physiology,2006,140(1):279-291.
[12]Noda N.Recent advances in the research and development of blue flowers[J].Breeding Science,2018,68(1):79-87.
[13]Deng Y X,Li C L,Li H Q,et al.Identification and characterization of flavonoid biosynthetic enzyme genes in Salvia miltiorrhiza(Lamiaceae)[J].Molecules,2018,23(6):1467.
[14]Zhang J X,Zhou L B,Zheng X Y,et al.Overexpression of SmMYB9b enhances tanshinone concentration in Salvia miltiorrhiza hairy roots[J].Plant Cell Reports,2017,36(8):1297-1309.
[15]Luo H,Zhu Y,Song J,et al.Transcriptional data mining of Salvia miltiorrhiza in response to methyl jasmonate to examine the mechanism of bioactive compound biosynthesis and regulation[J].Physiologia Plantarum,2014,152(2):241-255.
[16]Xu H,Song J,Luo H,et al.Analysis of the genome sequence of the medicinal plant Salvia miltiorrhiza[J].Molecular Plant,2016,9(6):949-952.
[17]Holton T A,Brugliera F,Lester D R,et al.Cloning and expression of cytochrome P450 genes controlling flower color[J].Nature,1993,366(6452):276-279.
[18]Froemel S,de Vlaming P,Stotz G,et al.Genetic and biochemical studies on the conversion of flavanones to dihydroflavonols in flowers of Petunia hybrida[J].Theoretical and Applied Genetics,1985,70(5):561-568.
[19]Meyer P,Heidmann I,Forkmann G,et al.A new petunia flower colour generated by transformation of a mutant with a maize gene[J].Nature,1987,330(6149):677-678.
[20]Winkel B.Metabolic channeling in plants[J].Annual Review of Plant Biology,2004,55:85-107.
[21]Saslowsky D,Winkel-Shirley B.Localization of flavonoid enzymes in Arabidopsis roots[J].Plant Journal,2001,27(1):37-48.
[22]宋经元,徐志超,陈士林.本草基因组学专辑简介[J].中国科学:生命科学,2018,48(4):349-351.
[23]Xin TY,Zhang Y,Pu XD,et al.Trends in Herbgenomics[J].Science China:Life Sciences,2019,62(3):288-308.
[24]宋经元,罗红梅,李春芳,等.丹参药用模式植物研究探讨[J].药学学报,2013,48(7):1099-1106.
Cloning and Expression Analysis of F3′5′H from Salvia Miltiorrhiza
文章来源:《世界睡眠医学杂志》 网址: http://www.sjsmyxzz.cn/qikandaodu/2020/0522/368.html

